
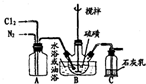
 黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下:
黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下: .
.分析 (1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾为氯化氢气体形成,结合原子守恒配平书写化学方程式;
(2)二氯化二硫遇水会反应,装置B中制备二氯化二硫不能含水蒸气,通入的氯气需要浓硫酸干燥;
(3)①先通入氮气排净装置中空气,避免硫单质和空气中氧气发生反应;
②硫与氯气在50~60℃直接化合生成二氯化二硫,控制此温度需要水浴加热;
③停止加热,加大通入氯气量,维持16h,说明反应是放热反应;
(4)S2Cl2是展开书页型结构,Cl-S位于两个书页面内,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对;
(5)装置C是利用氯气和碱溶液反应,来吸收剩余氯气,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,是工业漂白粉的制备原理;
(6)在装置B、C之间安装干燥管吸收水分,需要选择固体干燥剂.
解答 解:(1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾为氯化氢气体形成,反应的化学方程式为:2S2Cl2+2H2O=SO2+3S+4HCl,
故答案为:2S2Cl2+2H2O=SO2+3S+4HCl;
(2)二氯化二硫遇水会反应,装置B中制备二氯化二硫不能含水蒸气,通入的氯气需要浓硫酸干燥,
故答案为:浓硫酸;
(3)①先通入氮气排净装置中空气,避免硫单质和空气中氧气发生反应,
故答案为:防止硫加热时与氧气反应;
②硫与氯气在50~60℃直接化合生成二氯化二硫,控制此温度需要水浴加热,
故答案为:水浴;
③停止加热,加大通入氯气量,维持16h,说明反应过程中是放热反应,反应放出的热量保证反应继续进行,
故答案为:放热;
(4)S2Cl2是展开书页型结构,Cl-S位于两个书页面内,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,电子式为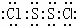 ,
,
故答案为: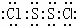 ;
;
(5)氯气和碱溶液反应,装置C的作用是用来吸收剩余氯气,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,是工业漂白粉的制备原理,
故答案为:吸收多余氯气;漂白粉或漂粉精;
(6)为了得到更纯的二氯化二硫,需要在装置B、C之间安装干燥管,其内盛试剂选择中性或酸性固体干燥剂,选择氯化钙或五氧化二磷做干燥剂,
故答案为:氯化钙或五氧化二磷.
点评 本题考查了实验制备物质的分析判断,主要是装置作用和试剂选择的目的、实验基本操作等知识点,注意题干信息的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
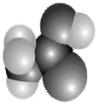 某常见有机物(只含碳、氢、氧三种元素)分子的比例模型如图所示.请根据其结构特点判断下列有关说法中正确的是( )
某常见有机物(只含碳、氢、氧三种元素)分子的比例模型如图所示.请根据其结构特点判断下列有关说法中正确的是( )| A. | 全部正确 | B. | 只有②错误 | C. | 只有③ | D. | 全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
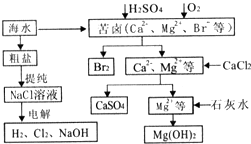 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 | |
| C. | 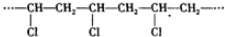 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 等质量的CH4、C2H4、C4H6分别在空气中充分燃烧,所耗用氧气的量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
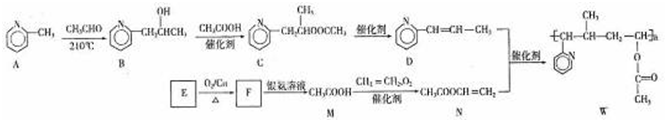
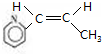 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$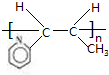 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | Y形成的离子与Z形成的离子的电子数可能相同 | |
| C. | 化合物ZY、WY3 中化学键的类型相同 | |
| D. | 由X、Y、Z、W组成的化合物的水溶液不可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com