
| AЈ®К№УГ»·РОІЈБ§ҪБ°и°фКЗОӘБЛјУҝм·ҙУҰЛЩВКЈ¬јхРЎКөСйОуІо |
| BЈ®ОӘБЛЧјИ·Ів¶Ё·ҙУҰ»мәПИЬТәөДОВ¶ИЈ¬КөСйЦРОВ¶ИјЖЛ®ТшЗтУҰУлРЎЙХұӯөЧІҝҪУҙҘ |
| CЈ®УГ0.5molЎӨLЈӯ1NaOHИЬТә·ЦұрУл0.5 molЎӨLЈӯ1өДСОЛбЎўҙЧЛбИЬТә·ҙУҰЈ¬ИзЛщИЎөДИЬТәМе»эПаөИЈ¬ФтІвөГөДЦРәНИИКэЦөПаН¬ |
| DЈ®ФЪІв¶ЁЦРәНИИКөСйЦРРиТӘК№УГөДТЗЖчУРЈәМмЖҪЎўБҝНІЎўЙХұӯЎўөО¶Ё№ЬЎўОВ¶ИјЖ |
 ¶б№ЪҪрҫнИ«ДЬБ·ҝјПөБРҙр°ё
¶б№ЪҪрҫнИ«ДЬБ·ҝјПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
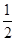 O2ЈЁgЈ©=CO2ЈЁgЈ© ЎчH= ЎӘ283kJ/mol
O2ЈЁgЈ©=CO2ЈЁgЈ© ЎчH= ЎӘ283kJ/mol H2ЈЁgЈ©+CO2ЈЁgЈ©ЎчH=
H2ЈЁgЈ©+CO2ЈЁgЈ©ЎчH=  H2ЈЁgЈ©+CO2ЈЁgЈ©ПВБРДЬЕР¶ПёГ·ҙУҰҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДКЗ (МоЧЦДё)ЎЈ
H2ЈЁgЈ©+CO2ЈЁgЈ©ПВБРДЬЕР¶ПёГ·ҙУҰҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДКЗ (МоЧЦДё)ЎЈ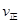 (CO)=
(CO)=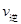 (H2O) dЈ®c(CO)=c(H2)
(H2O) dЈ®c(CO)=c(H2)  H2ЈЁgЈ©+CO2ЈЁgЈ©Ј¬өГөҪИзПВИэЧйКэҫЭЈә
H2ЈЁgЈ©+CO2ЈЁgЈ©Ј¬өГөҪИзПВИэЧйКэҫЭЈә
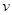 (CO2)ұнКҫөД·ҙУҰЛЩВКОӘ ЎЈ
(CO2)ұнКҫөД·ҙУҰЛЩВКОӘ ЎЈ CH3OHЈЁgЈ©+H2OЈЁgЈ©Ј¬УТНјұнКҫ
CH3OHЈЁgЈ©+H2OЈЁgЈ©Ј¬УТНјұнКҫ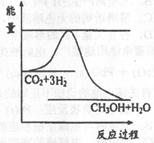

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
| AЈ®өИОпЦКөДБҝөДБтХфЖшәНБт№ММе·ЦұрНкИ«ИјЙХЈ¬әуХЯ·ЕіцИИБҝ¶а |
| BЈ®ә¬1 mol CH3COOHөДПЎИЬТәУлә¬1 mol NaOHөДПЎИЬТә»мәПЈ¬·ЕіцөДИИБҝРЎУЪ57.3 kJ |
| CЈ®УЙCЈЁКҜД«Ј©= CЈЁҪрёХКҜЈ©Ј»ЎчH=" +1.90" kJ/molҝЙЦӘЈ¬ҪрёХКҜұИКҜД«ОИ¶Ё |
| DЈ®ДЬЧФ·ўҪшРРөД·ҙУҰТ»¶ЁКЗ·ЕИИ·ҙУҰЈ¬І»ДЬЧФ·ўҪшРРөД·ҙУҰТ»¶ЁКЗОьИИ·ҙУҰ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв


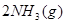 ЎчH=
ЎчH=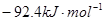 Ј¬әгОВЎўәгИЭЗТИЭ»эПаН¬өДБҪёцГЬұХИЭЖчAЎўBЈ¬AЦРНЁИл1molN2Ўў3 molH 2Ј¬B ЦРНЁИл0.5 molN2Ўў1.5 mol H 2Ј¬·ҙУҰТ»¶ОКұјдәуЈ¬AЎўBЦРҫщҙпөҪЖҪәвЧҙМ¬ЎЈПВБРЕР¶ПХэИ·өДКЗЈЁ Ј©
Ј¬әгОВЎўәгИЭЗТИЭ»эПаН¬өДБҪёцГЬұХИЭЖчAЎўBЈ¬AЦРНЁИл1molN2Ўў3 molH 2Ј¬B ЦРНЁИл0.5 molN2Ўў1.5 mol H 2Ј¬·ҙУҰТ»¶ОКұјдәуЈ¬AЎўBЦРҫщҙпөҪЖҪәвЧҙМ¬ЎЈПВБРЕР¶ПХэИ·өДКЗЈЁ Ј©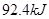

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
| AЈ®ИЬТәЦКБҝФцјУ | BЈ®ИЬТәөДОВ¶ИҪөөН |
| CЈ®ҫ§МеІ»ФЩИЬҪв | DЈ®ИЬТәөДОВ¶ИәНЦКБҝ¶јІ»ұд |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
| AЈ®ЙъіЙОпДЬБҝТ»¶ЁөНУЪ·ҙУҰОпЧЬДЬБҝ |
| BЈ®ПаН¬МхјюПВЈ¬2molЗвФӯЧУЛщҫЯУРөДДЬБҝРЎУЪ1molЗв·ЦЧУЛщҫЯУРөДДЬБҝ |
| CЈ®ёщҫЭёЗЛ№¶ЁВЙЈ¬ҝЙјЖЛгДіР©ДСТФЦұҪУІв¶ЁөД»ҜС§·ҙУҰөД·ҙУҰмКұд |
DЈ®Н¬ОВН¬С№ПВЈ¬ ФЪ№вХХәНөгИјМхјюөД ФЪ№вХХәНөгИјМхјюөД І»Н¬ І»Н¬ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 М¬Л®өДИИ»ҜС§·ҙУҰ·ҪіМКҪЈә
М¬Л®өДИИ»ҜС§·ҙУҰ·ҪіМКҪЈә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
| ОВ¶И/Ўж | 200 | 300 | 400 | 500 | 600 |
| °ұә¬Бҝ/% | 89.9 | 71.0 | 47.0 | 26.4 | 13. 8 8 |
 2NH3Ј¬2 minҙпөҪЖҪәвЧҙМ¬КұЈ¬H2ЧӘ»ҜВККЗ50%Ј¬ёГОВ¶ИПВөДЖҪәвіЈКэKЈҪ______________(УГ·ЦКэұнКҫ)Ј»УыК№KФцҙуЈ¬ҝЙТФІЙИЎөДҙлК©КЗ___________________ЎЈ
2NH3Ј¬2 minҙпөҪЖҪәвЧҙМ¬КұЈ¬H2ЧӘ»ҜВККЗ50%Ј¬ёГОВ¶ИПВөДЖҪәвіЈКэKЈҪ______________(УГ·ЦКэұнКҫ)Ј»УыК№KФцҙуЈ¬ҝЙТФІЙИЎөДҙлК©КЗ___________________ЎЈ
 2NH3(l) ЎчH=___________ЎЈ
2NH3(l) ЎчH=___________ЎЈІйҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com