
| A. | 通人H2S,有黄色沉淀 | |
| B. | 加入铜粉,溶液变为蓝色 | |
| C. | 加人锌粉,溶液棕黄色逐渐消失 | |
| D. | 滴加NaHCO3溶液,有气体和红棕色沉淀生成 |
分析 A、通人H2S,有黄色沉淀,说明生成单质,可能是酸性条件下硝酸根离子的氧化性,也可能是铁离子的氧化性;
B、加入铜粉溶液变蓝,说明生成铜离子;
C、加人锌粉,溶液棕黄色逐渐消失,说明铁离子被还原,则铁离子是氧化剂;
D、滴加NaHCO3溶液,与铁离子发生双水解,反应有二氧化碳气体和红棕色氢氧化铁沉淀生成.
解答 解:A、通人H2S,有黄色沉淀,说明生成单质,可能是酸性条件下硝酸根离子的氧化性,也可能是铁离子的氧化性,所以不能说明铁元素具有氧化性,故A错误;
B、加入铜粉溶液变蓝,说明生成铜离子,可能是酸性条件下硝酸根离子的氧化性,也可能是铁离子的氧化性,所以不能说明铁元素具有氧化性,故B错误;
C、加人锌粉,溶液棕黄色逐渐消失,说明铁离子被还原,则铁离子是氧化剂,则铁元素具有氧化性,故C正确;
D、滴加NaHCO3溶液,与铁离子发生双水解,反应有二氧化碳气体和红棕色氢氧化铁沉淀生成,非氧化还原反应,故D错误;
故选C.
点评 本题考查氧化还原的知识,为高频考点,把握发生的反应确定沉淀的成分为解答的关键,侧重氧化还原反应及复分解反应的考查,注意酸性条件下硝酸根离子的强氧化性,题目难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
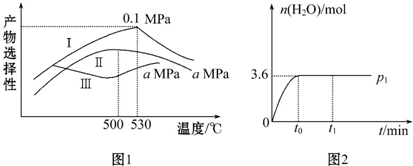
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的结构简式为: | B. | 乙醇的官能团的电子式为: | ||
| C. | S2-的结构示意图为: | D. | 乙酸的实验式为C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置除去乙烯中少量SO2气体 | |
| B. |  用图装置量取20.00 mL 0.10 mol•L-1硫酸 | |
| C. |  用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 | |
| D. |  用图装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
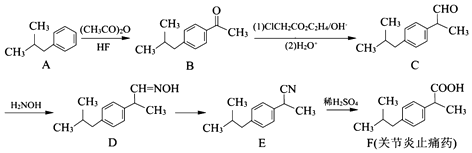
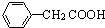 (任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.
(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.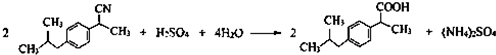 .
.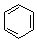 $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$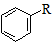

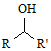 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烃基
R、R′表示烃基 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
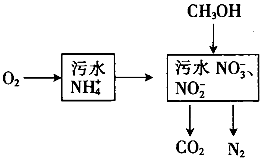 处理生活污水中的NH4+,过程如下:
处理生活污水中的NH4+,过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与I2生成ICl是非氧化还原反应 | |
| B. | 反应①中,每生成1 mol ZnCl2时转移2mol电子 | |
| C. | 反应①中,ZnI2既是氧化产物又是还原产物 | |
| D. | 反应②中,ICl既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO${\;}_{3}^{-}$、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH${\;}_{4}^{+}$、K+、Cl-、I- | |
| D. | 澄清透明的溶液中:Cu2+、K+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com