
| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
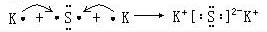 ,
,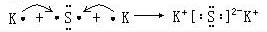 ;
;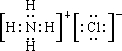 ,含离子键和共价键,
,含离子键和共价键,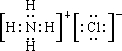 ;离子键和共价键;
;离子键和共价键;
| ||
| ||


科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 |
| B、Fe与稀硫酸反应制取H2时,增大压强 |
| C、用H2O2制取O2的实验中,改用2倍浓度的H2O2 |
| D、Al在氧气中燃烧生成A1203,将Al片改成Al粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向漂白粉溶液中通入少量SO2气体:Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl- |
| B、向盐酸中逐滴加入等体积等浓度的碳酸钠溶液:CO32-+2H+═CO2↑+H2O |
| C、KHC2O4使酸性KMnO4溶液褪色:5C2O42-+16H++2MnO4-═10CO2↑+2Mn2++8H2O |
| D、向银氨溶液中加入足量的氢碘酸溶液:〔Ag(NH3)2〕++OH-+3H+═Ag++H2O+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com