解答:解:(1)在过程Ⅰ中发生反应2C+SiO
2Si+2CO↑中,C从0价变为一氧化碳中的+2价,发生氧化反应是还原剂;
故答案为:还原剂;
(2)电解饱和食盐水的方法制备氯气,阳极,溶液中氯离子失电子发生氧化反应生成氯气,2Cl
--2e=Cl
2↑,阴极,溶液中氢离子得到电子发生还原反应,生成氢气,2H
++2e
-═H
2↑,总的反应为2NaCl+2H
2O
2NaOH+Cl
2↑+H
2↑,
故答案为:2NaCl+2H
2O
2NaOH+Cl
2↑+H
2↑;
(3)①根据SiCl
4遇水剧烈水解生成SiO
2和一种酸信息,反应物是SiCl
4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢,氯化氢前的系数为4,据此即可写出化学反应方程式,
故答案为:SiCl
4+2H
2O═SiO
2+4HCl;
②干燥Cl
2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,此时使水蒸气冷凝,然后再通入到浓H
2SO
4中,进入浓硫酸的水量少了,保证浓硫酸的良好吸水性,水和浓硫酸作用放热,所以进入硫酸的水少了,能降低放出的热量,
故答案为:使水蒸气冷凝减少进入浓硫酸的水量保持持续的吸水性并降低放出的热量;
(4)①对于三个反应,反应热都是△H<0表示放热,
a.升高温度,平衡向吸热的方向移动,所以会降低SiCl
4的转化率,故a错误;
b.Si遇氧气在高温的条件下反应生成二氧化硅,所以还原过程需在无氧的气氛中进行,b正确;
c.有气体参加的反应,增大压强,能加快反应的速率,对于三个反应,都有气体参与,所以增大压强,能提高反应的速率,故c正确;
d.Na、Mg都是还原性比较强的金属,可以代替Zn还原SiCl
4,故d正确;
故答案为:bcd;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,反应物都为气态,温度高,反应速率更快,所以实际制备过程选择“反应3”,温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率,
故答案为:温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率;
③每投入1mol SiCl
4,有2molZn参加反应,“反应3”与“反应2”比较,反应2中锌为液态,根据Zn(l)═Zn(g)△H=+116KJ/mol,若SiCl
4的转化率均为90%,“反应3”比“反应2”多放出116KJ/mol×2×90%=208.8KJ,
故答案为:208.8;
(5)二氧化硅和氢氟酸:SiO
2+4HF=SiF
4↑+2H
2O;SiF
4+2HF=H
2SiF
6,所以用稀HNO
3和HF的混合液,硅表面首先形成SiO
2,最后转化为H
2SiF
6的化学方程式为SiO
2+6HF═H
2SiF
6+2H
2O,
故答案为:SiO
2+6HF═H
2SiF
6+2H
2O;




 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案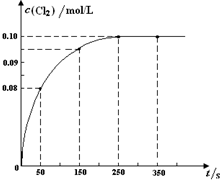 (2013?朝阳区二模)温度为T时,向2L恒容密闭容器中充入1mol PCl5,发生PCl5(g)?PCl3(g)+Cl2(g)反应.反应过程中c(Cl2) 随时间变化的曲线如图所示,下列说法不正确的是( )
(2013?朝阳区二模)温度为T时,向2L恒容密闭容器中充入1mol PCl5,发生PCl5(g)?PCl3(g)+Cl2(g)反应.反应过程中c(Cl2) 随时间变化的曲线如图所示,下列说法不正确的是( )