
 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,电解液为酸性环境.请回答下列问题:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,电解液为酸性环境.请回答下列问题:分析 葡萄糖与氧气形成的燃料电池中,葡萄糖在负极失电子而被氧化,电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,
氧气在正极得电子而被还原,正极反应为602+24H++24e-=12H2O,
放电过程中,H+从负极区向正极区迁移,
由C6H12O6+6H2O-24e-=6CO2+24H+计算出:转移4mole-则生成1molCO2.
解答 解:(1)葡萄糖在负极失电子而被氧化,电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,氧气在正极得电子而被还原,正极反应为602+24H++24e-=12H2O,则该电池总反应为:C6H12O6+6O2=6CO2+6H2O;
故答案为:C6H12O6;602+24H++24e-=12H2O;C6H12O6+6O2=6CO2+6H2O;
(2)原电池工作时,电解质中阳离子向正极移动,阴离子向负极移动,从而形成闭合回路,放电过程中,H+从负极区向正极区迁移,
故答案为:负极;正极;
(3)由C6H12O6+6H2O-24e-=6CO2+24H+计算出:转移4mole-则生成1molCO2,则标准状况下CO2气体的体积为22.4L,
故答案为:22.4L.
点评 本题考查化学电源新型电池,明确正负极判断与元素化合价变化关系是解本题关键,难点是电极反应式的书写,题目难度中等,侧重于考查学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锂在放电时做正极材料,充电时为阳极材料 | |
| B. | 电池在放电时,Li+向正极移动 | |
| C. | 该电池充电时阳极的反应为:LixV2O5-xe-=V2O5+xLi+ | |
| D. | V2O5只是锂发生反应的载体,不参与电池反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是七个基本物理量之一 | |
| B. | 阿伏加德罗常数就是6.02×1023mol-1 | |
| C. | 1mol氢的质量是2g | |
| D. | 1个甲烷分子的质量是2.66×10-23g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C原子结构示意图: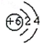 | |
| B. | 白磷的分子式:P | |
| C. | 含有七个中子的碳原子的核组成符号:${\;}_{12}^{6}$C | |
| D. | 次氯酸的结构式为:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液,有白色沉淀生成,可判定含有Cl- | |
| B. | 先加入足量稀盐酸,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42- | |
| C. | 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ | |
| D. | 加入盐酸后有无色、无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com