
【题目】按要求完成下列问题:
![]()
(1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。
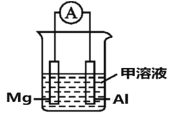
(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。
(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。
(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。
【答案】Al3+ + 3AlO2- +4H2O =4Al(OH)3↓ Ba(NO3)2 AgNO3 C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol 2H+ + 2e- = H2↑ Al - 3e- + 4OH- = AlO2 -+ 2H2O CH3OH- 6e- + 8OH- = CO32-+6 H2O 12.8
【解析】
(1)根据A、B、C之间的转化关系,若A为AlCl3,AlCl3可以与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠反应生成偏铝酸钠,氯化铝与偏铝酸钠能够反应生成氢氧化铝沉淀,据此分析解答;
(2)检验Na2SO4和NaCl混合溶液中的Cl-需要首先除去硫酸根离子,防止硫酸根离子的干扰,据此分析解答;
(3)根据H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,书写出相关的热化学方程式,再根据盖斯定律分析解答;
(4)Mg、Al设计成原电池装置:若电解液为盐酸,镁比铝活泼,镁为负极,铝为正极;若电解液为氢氧化钠溶液,镁与氢氧化钠不反应,此时铝为负极,镁为正极,据此分析解答;
(5)用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料时,负极上甲醇发生氧化反应生成碳酸根离子,据此书写负极的电极反应式;
(6)铅蓄电池的总反应为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,据此分析解答。
2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,据此分析解答。
(1)根据A、B、C之间的转化关系,若A为AlCl3,AlCl3可以与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠反应生成偏铝酸钠,氯化铝与偏铝酸钠能够反应生成氢氧化铝沉淀,因此A和C反应的离子方程式为Al3+ + 3AlO2- +4H2O =4Al(OH)3↓,故答案为:Al3+ + 3AlO2- +4H2O =4Al(OH)3↓;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量Ba(NO3)2溶液,充分震荡后静置,除去硫酸根离子,防止硫酸根离子的干扰,然后取上层清液于试管中,再加入几滴AgNO3溶液,产生白色沉淀,可以检验Na2SO4和NaCl混合溶液中的Cl-,故答案为:Ba(NO3)2;AgNO3;
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,①H2(g)+![]() O2(g)=H2O(l)△H=-akJmol-1,②CO(g)+
O2(g)=H2O(l)△H=-akJmol-1,②CO(g)+![]() O2(g)=CO2(g)△H=-bkJmol-1,1mol液态水变为气态水吸收ckJ热量,则③H2O(l)= H2O(g) △H=+ckJ∕mol,④C(s) + H2O(g)= CO(g)+ H2(g)△H=+dkJ∕mol,依据盖斯定律,将①+②+③+④得:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol,故答案为:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol;
O2(g)=CO2(g)△H=-bkJmol-1,1mol液态水变为气态水吸收ckJ热量,则③H2O(l)= H2O(g) △H=+ckJ∕mol,④C(s) + H2O(g)= CO(g)+ H2(g)△H=+dkJ∕mol,依据盖斯定律,将①+②+③+④得:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol,故答案为:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol;
(4)Mg、Al设计成原电池装置:若电解液为盐酸,镁比铝活泼,镁为负极,铝为正极,正极的电极反应为2H+ + 2e- = H2↑。若电解液为氢氧化钠溶液,镁与氢氧化钠不反应,此时铝为负极,负极的电极反应式为Al - 3e- + 4OH- = AlO2-+ 2H2O,故答案为:2H+ + 2e- = H2↑;Al - 3e- + 4OH- = AlO2-+ 2H2O;
(5)用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料时,负极上甲醇发生氧化反应生成碳酸根离子,负极的电极反应式为CH3OH- 6e- + 8OH- = CO32-+6 H2O,故答案为:CH3OH- 6e- + 8OH- = CO32-+6 H2O;
(6)铅蓄电池的总反应为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4。若铅蓄电池负极质量增加19.2g,转移的电子的物质的量为
2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4。若铅蓄电池负极质量增加19.2g,转移的电子的物质的量为![]() ×2=0.4mol,则正极上0.2mol PbO2转化为0.2mol PbSO4,质量增加的量相当于增加了0.2molSO2,质量为0.2mol×64g/mol=12.8g,故答案为:12.8。
×2=0.4mol,则正极上0.2mol PbO2转化为0.2mol PbSO4,质量增加的量相当于增加了0.2molSO2,质量为0.2mol×64g/mol=12.8g,故答案为:12.8。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是( )

A.正、负极的质量均减少
B.电子由AgCl经外电路流向Mg
C.AgCl电极发生氧化反应
D.该装置实现了电能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
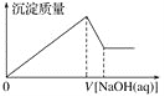
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.8.4g乙烯和丙烯混合气体中含C-H键个数为1.2NA个
B.盛有NO2的密闭容器在含有NA个氧原子,则NO2的物质的量是0.5mol
C.标准状况下,22.4L二氯甲烷的分子数为NA个
D.电解精炼铜时,若阳极质量减少64g,则阴极得电子数为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:
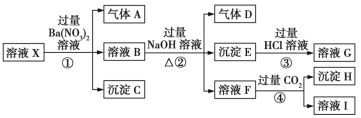
(1)沉淀C是___(填化学式),由此可确定溶液X中肯定不存在的阳离子有___。
(2)气体A是___(填化学式),产生气体A的离子方程式为___。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有___,可能存在的离子有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
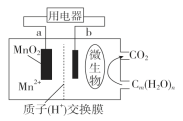
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
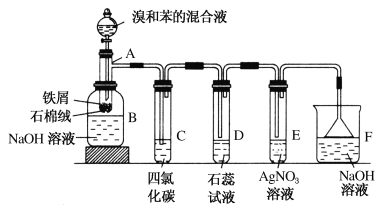
填写下列空白:
①试管A中的反应方程式为_______________。
②试管C中四氯化碳的作用是:____________。反应开始后,观察D和E两试管,看到的现象为:_________________。写出E中反应的离子方程式_____________________。
③在上述整套装置中,具有防倒吸功能的仪器有_____(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a. 配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b. 向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c. 在55~60 ℃下发生反应,直至反应结束;
d .除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e. 将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:___________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是___________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)填写下列表格:
物质 | 分子数 | 质量/g | 物质的量/ mol | 摩尔质量/(g |
O2 | __ | 8.0 | __ | __ |
H2SO4 | 3.01×1023 | __ | __ | __ |
H2O | __ | __ | 0.5 | __ |
(2)147gH2SO4的物质的量是____;0.5molH2SO4的质量是____g,其中含有____mol H;2 mol H2SO4中含有H2SO4分子数为_____个,含氢原子数为____个。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____,R的相对原子质量为____。含R的质量为1.6 g的Na2R,其物质的量为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com