
分析 (1)Fe2O3与硫酸反应生成硫酸铁,铁离子遇KSCN溶液红色;
(2)红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
解答 解:(1)若红色粉末是Fe2O3,Fe2O3与硫酸反应生成硫酸铁,没有红色不溶物,滴加KSCN溶液,溶液变为红色,
故答案为:没有红色不溶物,滴加KSCN溶液,溶液变为红色;
(2)红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,所以说法不合理,
故答案为:不合理;Cu能将Fe3+还原为Fe2+;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应,反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;根据方程式知道:n(Fe2O3):n(Cu2O)=1:1,则质量比为:m(Fe2O3):m(Cu2O)=10:9,
故答案为:10:9;Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO△m
288g 32g
m (b-a)g
m=$\frac{288×(b-a)g}{32g}$=9(b-a)g,混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%,
故答案为:$\frac{9(b-a)}{a}$×100%.
点评 本题考查实验的设计及评价,以及物质的组成的测定,难度较大,注意把握题给信息,是对所需知识的综合考查,需要学生具有扎实的基础与综合运用分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 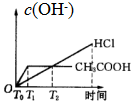 | B. | 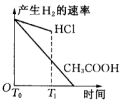 | C. |  | D. | 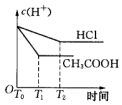 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
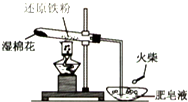 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
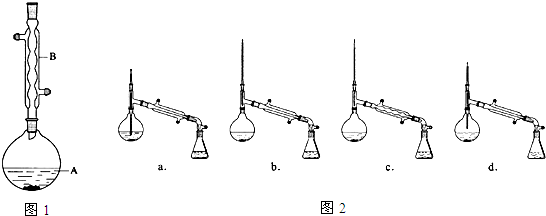
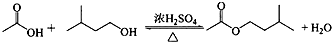
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
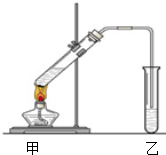 (1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);
(1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
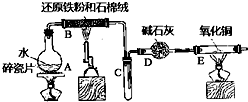 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com