
【题目】从固体混合物A出发可以发生如下框图所示的一系列变化.
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察).回答下列问题:
(1)在实验室中收集气体C,可选择下图装置中的 . 
(2)操作②的名称是 . 在操作②中所使用的玻璃仪器的名称是 . 在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的目 .
(3)写出反应①的化学方程式、反应④的离子方程式:反应①: ,
反应④: .
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如图中的装置,其中瓶Ⅰ中盛放的是 , 瓶Ⅱ中盛放的是 .
(5)实验中必须吸收多余的气体F,以免污染空气.下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是 . 
【答案】
(1)AC
(2)过滤;漏斗、玻璃棒、烧杯;除去附着在MnO2表面的K+、Cl﹣等离子
(3)2KClO3 ![]() 2KCl+3O2↑;MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O
2KCl+3O2↑;MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O
(4)饱和食盐水;浓H2SO4
(5)BCD
【解析】解:F为黄绿色气体,则F为Cl2 , 反应④为二氧化锰与浓盐酸的反应,则D为MnO2 , I为MnCl2 , G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色,则G为AgCl,H为KNO3 , E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3 ![]() 2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2 , (1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选C用向上排空气法收集,所以答案是:AC;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl﹣等离子,然后再干燥,所以答案是:过滤;漏斗、玻璃棒、烧杯;除去附着在MnO2表面的K+、Cl﹣等离子;(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2 , (1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选C用向上排空气法收集,所以答案是:AC;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl﹣等离子,然后再干燥,所以答案是:过滤;漏斗、玻璃棒、烧杯;除去附着在MnO2表面的K+、Cl﹣等离子;(3)反应①的化学方程式为2KClO3 ![]() 2KCl+3O2↑,反应④的离子反应为MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O,所以答案是:2KClO3
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O,所以答案是:2KClO3 ![]() 2KCl+3O2↑;MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,所以答案是:饱和食盐水;浓H2SO4;(5)用NaOH溶液吸收气体氯气的装置,为防止产生倒吸现象,装置中有倒扣的漏斗或肚容式结构,A装置不具有防倒吸的作用,而B、C、D具有,所以答案是:BCD.
2KCl+3O2↑;MnO2+2Cl﹣+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,所以答案是:饱和食盐水;浓H2SO4;(5)用NaOH溶液吸收气体氯气的装置,为防止产生倒吸现象,装置中有倒扣的漏斗或肚容式结构,A装置不具有防倒吸的作用,而B、C、D具有,所以答案是:BCD.
【考点精析】通过灵活运用氯气的实验室制法,掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O即可以解答此题.


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 某物质只含一种元素,该物质一定是纯净物
B. 金刚石和石墨的性质相同
C. H2和D2互为同位素
D. 40K和40Ca原子中质子数和中子数都不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,D,E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )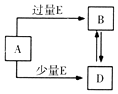
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是NaOH溶液,E是CO2 , 则B为NaHCO3
D.若A是A1Cl3溶液,E可能是稀氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法.古代有:(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜.现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁.对它们的冶炼方法的分析,不正确的是( )
A.Ⅰ,①
B.Ⅱ,②
C.Ⅲ,③
D.Ⅳ,④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制法错误的是
A.氨气:加热氢氧化钙和氯化铵的混合物
B.金属锰:高温下铝和二氧化锰反应
C.粗硅:高温下焦炭还原二氧化硅,副产物为CO
D.硫酸:黄铁矿煅烧生成的气体经接触氧化后用浓硫酸吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 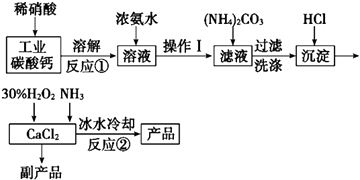
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质的分类角度来看,不恰当的一种物质是 .
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式: .
(3)“三酸”常用于溶解金属和金属氧化物.“三酸”分别溶解Fe2O3的离子方程式为:;稀硫酸、稀盐酸溶解铁的离子方程式为: .
(4)烧碱、纯碱溶液均可吸收CO2 , 当含0.1mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①;②Na2CO3;
③;④NaHCO3 .
若通入的CO2在标准状况下体积为1.792L,则得到固体的组成的化学式和物质的量分别是;将该固体全部溶于水,A、当向其中加入含0.02mol Ca(OH)2的石灰水,生成沉淀的质量为g;写出该反
应总的离子方程式:;
B、当向其中加入含0.07mol Ca(OH)2的石灰水,生成沉淀的质量为g,写出该反应总的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是( )
A.NaHSO4═Na++HSO ![]()
B.Al2(SO4)3═2Al3++3SO ![]()
C.NH4Cl═NH3+H++Cl﹣
D.H2CO3═2H++CO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com