
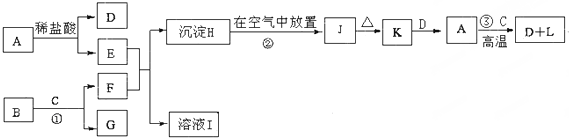


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
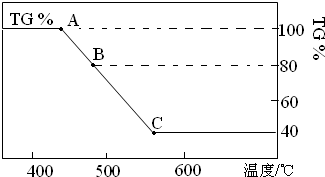
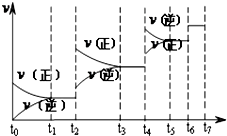
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中加入稀盐酸,无明显变化,再加入Ba(NO3)2溶液后,产生白色沉淀,说明原来溶液中含有SO42- |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D、过量的锌与浓硫酸反应产生的气体是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业上制粗硅:SiO2+C
| ||||
B、海水提镁的主要步骤为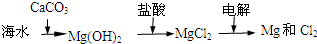 | ||||
C、海水提溴原理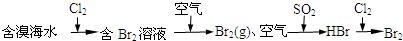 | ||||
| D、硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=10?2y |
| B、x=102y |
| C、x=y |
| D、x>y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com