
工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g)
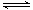 2SO3(g)
△H=-198kJ·mol-1
2SO3(g)
△H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
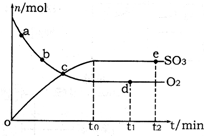
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是 (填序号)。
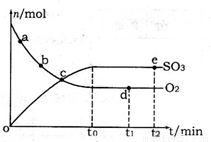
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应 (填“是”、“否”或“无法判断”)达到化学平衡状态,理由是 。
(1)AD(2分)(2)AC(2分)
(3)否(2分),400℃时,浓度熵Q=1600mol-1·L,而K(400℃)=7200mol-1·L,Q<K,反应没有达到平衡状态;(2分)
【解析】
试题分析:(1)A、每生成1mol SO3的同时生成0.5mol O2,说明正逆反应速率相等,反应达到平衡状态,故A正确;B、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故B错误;C、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;D、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故D正确;故选:AD;
(2)A.反应物浓度越大,反应速率越快,故a点时刻的正反应速率比b点时刻的大,故A正确;B.a、b、c三点未到达平衡状态,反应向正反应进行,故B错误;C.d、e两点处于平衡状态,温度相同,C(O2)相等,n(O2)相同,故C正确;D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡时三氧化硫的物质的量减小,故D错误;故答案为:AC;
(3)
2SO2(g)十O2(g)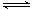 2SO3
2SO3
起始(mol/L) 0.05 0.03 0
反应(mol/L) 0.04 0.02 0.04
一段时间后(mol/L)0.01 0.01 0.04
400℃时,浓度熵Q=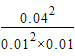 =1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
=1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
考点:考查化学平衡常数及化学平衡状态的判断、化学平衡图象。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届山东省济南外国语学校高二上学期期中考试化学(理)试卷 题型:选择题
工业上氧化二氧化硫制取三氧化硫反应的化学方程式为:2SO2+O2
 2SO3
2SO3
正反应放热,为了提高二氧化硫的转化率,下列措施可行的是( )
A.增大氧气的物质的量 B.减小氧气的物质的量
C.增大二氧化硫的物质的量 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上氧化二氧化硫制取三氧化硫反应的化学方程式为:2SO2+O2 ![]() 2SO3
2SO3
正反应放热,为了提高二氧化硫的转化率,下列措施可行的是( )
A.增大氧气的物质的量 B.减小氧气的物质的量
C.增大二氧化硫的物质的量 D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com