
【题目】随着能源与环境问题越来越被人们关注,碳-化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
(1)将CO2转化成有机物课有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2O![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是_______(填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入![]() 和
和![]() ,在催化剂作用下合成甲醇:CO(g)+2H2(g)
,在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
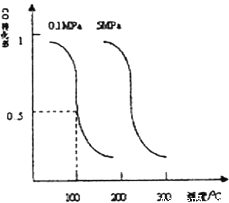
①该反应属于_______反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是____(填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②100℃时,该反应的平衡常数K=________(用a,b的代数式表示)。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)CH3OH(g) △H1=-90.8kJmol-1
b.2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-23.5kJmol-
c.CO(g)+H2O(g)CO2(g0+H2(g)△H3=-41.3kJmol
总反应:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的△H=___.
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是_____(填字母)。
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为_______。
(5)碳化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式____________。
【答案】 c 放热 c b2/a2 -246.4kJmol-1 cd CH3OCH3-12e-+16OH-=2CO32-+11H2O 2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
【解析】(1)反应物全部转化为生成物,原子利用率最高,上述四个反应中,只有c符合题意要求;正确选项 c。
(2)①根据图像可知,当压强不变时,温度升高,CO的转化率减小,平衡左移,该反应为放热反应;可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该反应在通常条件下一定可以发生,该反应可能需要催化剂才可以进行,a错误;可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该条件下反应速率很快,b错误;可逆反应的平衡常数很大,说明反应进行的程度很大,反应达平衡时至少有一种反应物的百分含量很小,c正确;可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该反应是吸热还是放热,d错误;正确答案:放热 ;c 。
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol。
所以平衡时,CO的浓度为0.5a/b= a/2b mol/L, H2的浓度为a/b=mol/L,CH3OH的浓度为0.5a/b=a/2b mol/L,100℃时该反应的平衡常数K═ =
=![]() ;正确答案:b2/a2。
;正确答案:b2/a2。
(3)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则ΔH=-90.8×2-23.5-41.3=-246.4 kJ/mol;正确答案:-246.4kJmol-1。
②平衡时各物质物质的量相等决定于开始加入物质的多少和反应限度,与平衡状态无关,所n(CH3OH)=n(CH3OCH3)=n(H2O) ,无法判断是否达到平衡状态,a错误;该反应是体积不变的反应,容器内压强恒为定值,无法判断是否达到平衡状态, b错误;反应达到平衡后,各物质的浓度保持不变,因此H2O(g)的浓度保持不变,可以判断反应达到平衡状态, c正确;C. 当CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1时,才能表示正逆反应速率,且满足计量数关系,说明达到了平衡状态, d正确;正确选项cd。
(4)二甲醚-空气组成燃料电池,二甲醚做负极,发生氧化反应,负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;正确答案:CH3OCH3-12e-+16OH-=2CO32-+11H2O。
(5)CO与氮氧化物(NOx)在有催化剂的条件下反应生成二氧化碳和氮气,化学方程式为:2xCO+2NOx![]() 2xCO2+N2;正确答案:2xCO+2NOx
2xCO2+N2;正确答案:2xCO+2NOx![]() 2xCO2+N2。
2xCO2+N2。


科目:高中化学 来源: 题型:
【题目】下列各基态原子核外电子排布表示正确的是( )
A. 钠原子—1s22s22p7 B. 铜原子—1s22s22p63s23p63d94s2
C. 铁原子—1s22s22p63s23p63d8 D. 氪原子—1s22s22p63s23p63d104s24p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以证明2HI(g) ![]() H2(g)+I2(g)己达平衡状态的是
H2(g)+I2(g)己达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI
②一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④c(HI):c(H2):c(I2)=2:1:1
⑤温度和体积一定时,某一生成物浓度不再变化
⑥温度和体积一定时,容器内压强不再变化
⑦一定条件下,混合气体的平均相对分子质量不再变化
⑧温度和体积一定时混合气体的颜色不再变化
A. ②③④⑥ B. ②⑥⑦⑧ C. ①②⑥⑦ D. ②⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:mA(g)+nB(g)![]() pC(g)+gD(g)的v-t图象如图甲所示。若其他条件都不变,只在反应前加入合适的催化剂,则其v-t图象如图乙所示。现有下列叙述:①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2。
pC(g)+gD(g)的v-t图象如图甲所示。若其他条件都不变,只在反应前加入合适的催化剂,则其v-t图象如图乙所示。现有下列叙述:①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2。
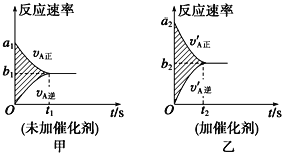
则以上所述各项正确的组合为
A. ②④⑥ B. ②④⑤ C. ②③⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是 ( )

A. 氢和R、W三种元素形成的阴离子有3种以上
B. RY2分子中每个原子的最外层均为8电子结构
C. R、Y、Z的最高价氧化物对应水化物的酸性依次增强
D. X、Z的氢化物的热稳定性和还原性,都依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R原子序数依次增大。考古时利用W的一种同位素测定一些文物的年代,X是地壳中含量最多的元素,Y、Z的质子数分别是W、X的质子数的2倍。下列说法错误的是
A. Y单质可以与WX2发生置换反应
B. 工业上常用电解熔融的Y与R形成的化合物的方法制取Y
C. 原子半径:Y>Z>R;简单离子半径:Z>X>Y
D. 可以用澄清的石灰水鉴别WX2与ZX2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com