
| A.元素电负性越大的原子,吸引电子的能力越强 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.在晶体钋(简单立方堆积)中,每个钋原子周围紧密相邻的钋原子有8个 |
| D.CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:填空题
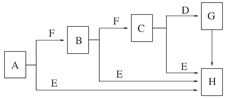
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.78 g Na2O2晶体中所含阴、阳离子个数均为4NA |
| B.HBr的电子式为H+[×·······]- |
| C.3.4 g氨气中含有0.6NA个N—H键 |
| D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 |
| B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 |
| C.非金属单质只能形成分子晶体 |
D.短周期元素离子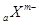 和 和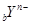 具有相同的电子层结构,若 具有相同的电子层结构,若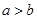 ,则 ,则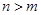 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Fe(CN)6]3->[Fe(SCN)6] 3- | B.[HgCl4] 2-> [HgF4] 2- |
| C.[AlF6] 3->[AlBr6] 3- | D.[Cu(NH3) 4]2+>[Zn(NH3) 4]2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从CCl4、NH4+为正四面体结构,可推测SiCl4、PH4+也为正四面体结构 |
| B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 |
| C.CO2为非极性分子,故SiO2也为非极性分子 |
| D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,故通入SO2生成CaSO3和HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
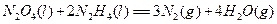
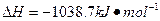
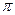 键有___________mol。
键有___________mol。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有离子键的化合物一定是离子化合物 |
| B.单质中不一定存在非极性键 |
| C.非金属原子之间只能构成共价化合物 |
| D.Cl2的沸点比F2高,这与分子间作用力的大小有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com