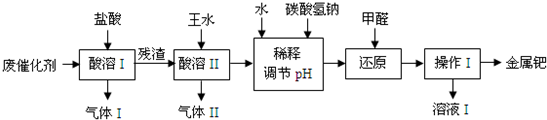
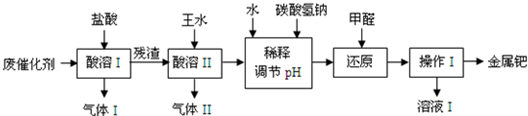
解:(1)铁和锌能与盐酸反应产生氢气;废催化剂的主要成分是钯和活性炭,还含有少量铁、锌,而实验的目的是从废催化剂中提取钯,所以酸溶I的目的是除去铁、锌等杂质,
故答案为:H2;除去铁、锌等杂质;
(2)王水是浓硝酸与盐酸按体积比1:3的混合物,浓硝酸具有氧化性,能将碳氧化生成二氧化碳,本身被还原成一氧化氮,反应的方程式为:C+4HNO3═CO2↑+4NO2↑+2H2O,
故答案为:1:3;C+4HNO3═CO2↑+4NO2↑+2H2O;
(3)氢氧化钠与二氧化氮、二氧化碳反应的方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O,2NaOH+CO2=Na2CO3+H2O 同时氢氧化钠过量,所以吸收后溶液中含有的溶质的化学式:NaOH、NaNO3、NaNO2、Na2CO3,故答案为:NaNO3;NaNO2;Na2CO3;
(4)NaHCO3能和盐酸发生反应,离子方程式为:HCO3-+H+═H2O+CO2↑,甲醛具有还原性,酸性条件下,甲醛会被硝酸氧化,
故答案为:HCO3-+H+═H2O+CO2↑;酸性条件下,甲醛会被硝酸氧化;
(5)金属钯不溶于水,利用过滤的方法分离,甲醛会被硝酸氧化生成甲酸,所以溶液I可能含有的有机离子为HCOO-,
故答案为:过滤;HCOO-;
(6)废催化剂中的含有活性炭,不断通入空气,能除去活性炭,同时减少王水的消耗,故答案为:除去废催化剂中的活性炭,减少王水的消耗.
分析:(1)根据铁和锌能与盐酸反应产生氢气;根据实验的目的以及废催化剂的主要成分是钯和活性炭,还含有少量铁、锌;
(2)根据王水的组成;根据浓硝酸具有氧化性,能将碳氧化生成二氧化碳,本身被还原成二氧化氮;
(3)根据氢氧化钠与二氧化氮、二氧化碳反应的方程式以及氢氧化钠过量来分析;
(4)根据NaHCO3能和盐酸发生反应;根据甲醛具有还原性;
(5)根据金属钯不溶于水;根据甲醛会被硝酸氧化生成甲酸;
(6)根据废催化剂中的含有活性炭,不断通入空气,能除去活性炭,同时减少王水的消耗.
点评:本题以从废催化剂中提取钯为背景,考查了金属的性质、物质的分离、化学方程式的书写,难度不大.



 +Ba2+═BaSO4↓
+Ba2+═BaSO4↓