
【题目】某溶液中可能含有![]() ,某同学为了确定其组分,设计并完成了如图实验:
,某同学为了确定其组分,设计并完成了如图实验:
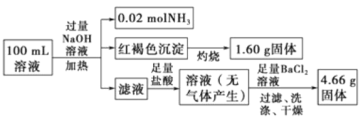
由此可推测原溶液中
A.一定存在![]() ,一定不存在
,一定不存在![]()
B.一定存在![]() ,一定不存在
,一定不存在![]()
C.![]() 至少为
至少为![]()
D.![]() 一定为
一定为![]()
【答案】C
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe2+或Fe3+或二者都有,则原溶液中一定没有CO32-;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子,由溶液为电中性可判断是否存在氯离子,以此来解答。
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02mol NH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe2+或Fe3+或二者都有,则原溶液中一定没有CO32-;由于加入了NaOH,无法判断原溶液中是否含有Na+;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,由电荷守恒可知原溶液中一定有Cl,物质的量至少为0.02mol×2+0.02mol0.02mol×2=0.02mol;
A. 原溶液中一定存在SO42-、NH4+、Cl-,一定不存在CO32-;由于第一步中加入了氢氧化钠溶液,引入了钠离子,无法确定原溶液中是否含有钠离子,故A错误;
B.由A项分析可知,无法确定原溶液中是否含有钠离子,故B错误;
C. 由以上分析可知,原溶液中一定存在0.02mol NH4+、0.02mol SO42-、0.02molFe2+或Fe3+或二者都有,若为Fe2+,正电荷物质的量为0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl,且c(Cl)(0.06mol0.04mol)/0.1L=0.2molL1,故C正确;
D. 由上述分析可知,原溶液中可能含有Fe2+或Fe3+或二者都有,则无法判断Fe3+的物质的量浓度,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
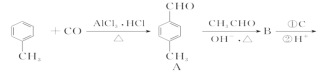
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
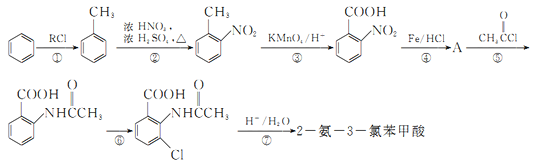
已知: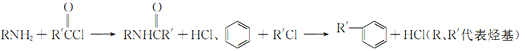
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
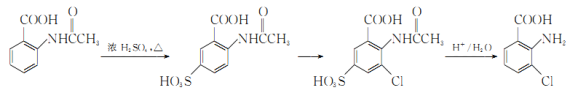
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:

已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液呈紫色且苯环上有两个取代基的A的同分异构体有_____________种,A中含官能团的名称为_______________________。
(2)试剂C可选用下列中的_________________。
a.溴水
b. 银氨溶液
c.酸性KMnO4溶液
d.新制Cu(OH)2悬浊液
(3) 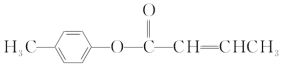 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
(4)D的分子式为______________,由D→E的反应类型是_________________,E在一定条件下可以生成高聚物F,F的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 某溶液中可能存在
某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等7种离子中的某几种,分别进行如下实验:
等7种离子中的某几种,分别进行如下实验:
![]() 向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
![]() 向所得橙色溶液中加入足量
向所得橙色溶液中加入足量![]() 溶液,无沉淀生成;
溶液,无沉淀生成;
![]() 向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
则下列说法正确的是![]()
A.肯定没有![]() B.肯定有
B.肯定有![]() 、
、![]()
C.可能有![]() D.可能有
D.可能有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可设计成原电池的化学反应是( )
A. H2O(l)+CaO(s)=Ca(OH)2(s)
B. Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
D. CH4(g)+2O2(g) ![]() CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含有![]() 的澄清溶液中,可能还含有
的澄清溶液中,可能还含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的几种。将该溶液进行如下实验:
六种离子中的几种。将该溶液进行如下实验:![]() 滴加适量新制氯水,有气泡生成,溶液变黄色;
滴加适量新制氯水,有气泡生成,溶液变黄色;![]() 向“
向“![]() ”中所得溶液中加入
”中所得溶液中加入![]() 溶液,无沉淀生成;
溶液,无沉淀生成;![]() 向“
向“![]() ”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中
”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中![]()
A.一定存在![]() 、
、![]() 、
、![]() B.无法确定
B.无法确定![]() 的存在
的存在
C.一定不存在![]() 、
、![]() 、
、![]() D.一定存在
D.一定存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
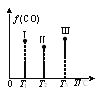
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是
等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是![]()
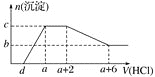
A.原溶液中可能含有![]() 、可能不含有
、可能不含有![]()
B.原溶液中一定含有的阴离子只有:![]() 、
、![]() 、
、![]()
C.原溶液中含![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com