【答案】
分析:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动;
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变;
(2)Mg(OH)
2、Cu(OH)
2的结构类型相同,溶度积越小,溶解度越小,加入相同的浓度的氨水,最先析出;氨水过量,氢氧化铜与氨水反应生成四氨合铜络离子;
(3)根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;
溶液中存在平衡NH
3.H
2O?NH
4++OH
-,根据溶液的pH值计算溶液中c(OH
-),根据氯离子浓度计算c(NH
4+),利用物料守恒计算溶液中c(NH
3.H
2O),代入NH
3?H
2O的电离常数表达式计算;
(4)根据平衡时三氧化硫的物质的量计算氧气的物质的量变化量,根据v=
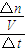
计算v(O
2);
再加入0.20mol SO
2和0.10mol O
2,等效为开始加入0.40mol SO
2和0.20mol O
2,等效为增大压强,平衡向正反应移动,二氧化硫的转化率增大,据此确定n(SO
3)的极小值,反应为可逆反应,假定完全反应确定n(SO
3)的极大值.
解答:解:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动,该反应正反应是体积减小的反应,故平衡向左移动.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:作,不改变;
(2)Mg(OH)
2、Cu(OH)
2的结构类型相同,Cu(OH)
2溶度积更小,溶解度越小,加入相同的浓度的氨水,Cu(OH)
2最先析出,反应离子方程式为:Cu
2++2NH
3.H
2O=Cu(OH)
2↓+2NH
4+,氨水过量,氢氧化铜与氨水反应生成四氨合铜络离子,离子方程式为:Cu(OH)
2+4NH
3.H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O,
故答案为:Cu
2++2NH
3.H
2O=Cu(OH)
2↓+2NH
4+,Cu(OH)
2+4NH
3.H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O;
(3)根据电荷守恒有c(NH
4+)+c(H
+)=c(Cl
-)+c(OH
-),由于c(NH
4+)=c(Cl
-),故c(H
+)=c(OH
-),溶液呈中性,故溶液中c(OH
-)=10
-7mol/L,溶液中c(NH
4+)=c(Cl
-)=

×0.01mol?L
-1=0.005mol?L
-1,故混合后溶液中c(NH
3.H
2O)=

×amol?L
-1-0.005mol?L
-1=(0.5a-0.005)mol/L,NH
3?H
2O的电离常数K
b=
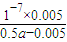
=
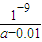
,
故答案为:中,
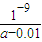
;
(4)平衡时三氧化硫的物质的量为0.18mol,由方程式可知,氧气的物质的量变化量为0.18mol×

=0.09mol,所以v(O
2)=

=0.036mol/(L?min),
再加入0.20mol SO
2和0.10mol O
2,等效为开始加入0.40mol SO
2和0.20mol O
2,等效为增大压强,平衡向正反应移动,二氧化硫的转化率增大,n(SO
3)的极小值为0.18mol×

=0.36mol,反应为可逆反应,假定完全反应n(SO
3)的极大值为0.4mol,故0.36mol<n(SO
3)<0.4mol,
故答案为:0.036,0.36mol<n(SO
3)<0.4mol.
点评:题目综合性较大,涉及化学平衡影响因素及计算、反应热、溶度积、溶液酸碱性判断、电离平衡常数计算等,是对知识的综合运用,注意(4)中运用等效思想与极值法进行范围的确定.

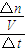 计算v(O2);
计算v(O2); ×0.01mol?L-1=0.005mol?L-1,故混合后溶液中c(NH3.H2O)=
×0.01mol?L-1=0.005mol?L-1,故混合后溶液中c(NH3.H2O)= ×amol?L-1-0.005mol?L-1=(0.5a-0.005)mol/L,NH3?H2O的电离常数Kb=
×amol?L-1-0.005mol?L-1=(0.5a-0.005)mol/L,NH3?H2O的电离常数Kb=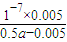 =
=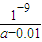 ,
,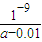 ;
; =0.09mol,所以v(O2)=
=0.09mol,所以v(O2)= =0.036mol/(L?min),
=0.036mol/(L?min), =0.36mol,反应为可逆反应,假定完全反应n(SO3)的极大值为0.4mol,故0.36mol<n(SO3)<0.4mol,
=0.36mol,反应为可逆反应,假定完全反应n(SO3)的极大值为0.4mol,故0.36mol<n(SO3)<0.4mol,


 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.