
下列物质既能与NaOH溶液反应,又能与盐酸反应的是
A.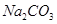 | B.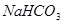 | C.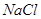 | D. |
科目:高中化学 来源: 题型:单选题
2.3g钠投入100g水中,下列叙述述错误的是
| A.钠浮在水面,熔化成银色光亮的小球 | B.钠贮存在煤油中 |
| C.所得溶液的质量分数为2.25﹪ | D.反应中转移0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
取等质量的钠进行下列实验,其中生成氢气最多的是
| A.将钠投入足量的水中 |
| B.将钠投入足量的稀硫酸中 |
| C.将钠用铝箔包好并刺一些小孔,再放入足量的水中 |
| D.将钠用耐热塑料薄膜包好并刺一些小孔,再放入足量的水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有铁的氧化物样品,用140ml0.5mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气56ml,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
| A.Fe2O3 | B.Fe3O4 | C.Fe5O7 | D.Fe4O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。 
正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题: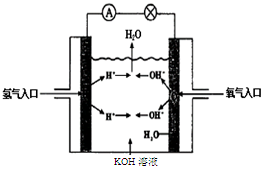
①负极反应式为 溶液PH (填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2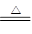 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。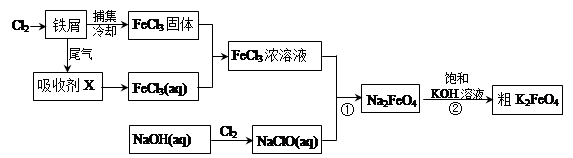
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com