
常温下,有关水溶液pH的下列说法中正确的是
A.在pH=12的溶液中,水电离出的c(OH-) =10-2mol·L-1 =10-2mol·L-1 |
| B.将pH=2和pH=12的酸、碱溶液等体积混合后,溶液的pH=7 |
| C.若强酸、强碱中和后pH=7,则中和之前pH酸+pH碱=14 |
| D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH>7 |
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:



 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
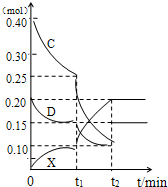 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。
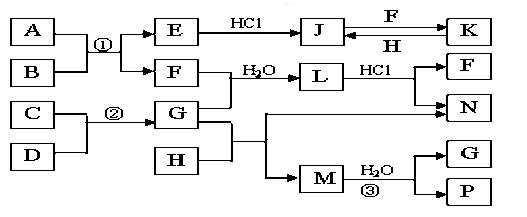
(1)化合物A中含有的两种元素是 (写元素符号)M的化学式_______
(2)如何检验化合物N中的阳离子
(3)写出K与H反应的离子方程式:
C与D反应的化学方程式:
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 ,原因是(用离子反应方程式表示)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 (写元素符号)(2分)M的化学式_______(1分)
(2)如何检验化合物N中的阳离子 (2分)
(3)写出K与H反应的离子方程式: (2分)
C与D反应的化学方程式: (2分)
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 (2分),原因是(用离子反应方程式表示) (2分)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com