
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H(kJ?mol-1) | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
| 1 |
| 2 |
| 7 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 103 |
| 3×Vm |
| 103 |
| 3×Vm |


科目:高中化学 来源: 题型:
方法一:在催化剂作用下乙烯与水反应
![]()
方法三:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]()
(1)你认为应用哪一种方法生产工业酒精能够缓解石油短缺带来的能源危机?为什么?__________________________________________
(2)方法一的化学反应方程式是:_____________________________________________。
(3)乙醇燃烧的化学方程式是:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中国在新工业化发展过程中,开发可再生能源以缓解石油短缺引起的能源危机是一个重要的课题。2003年元月份,辽宁省投资建设一个年产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量。已知制酒精的方法有三种:
方法一:在催化剂作用下乙烯与水反应
方法二:CH3-CH2Br + H2O![]() CH3CH2OH + HBr
CH3CH2OH + HBr
方法三:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
(1)你认为应用哪一种方法生产工业酒精能够缓解石油短缺带来的能源危机?为什么?
(2)方法一的化学反应方程式是:_________________________________________________。
(3)乙醇燃烧的化学方程式是:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
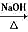 CH3CH2OH +HBr
CH3CH2OH +HBr 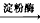 C6H12O6(葡萄糖)
C6H12O6(葡萄糖)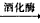 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑ 查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈尔滨九中高三第三次月考化学试卷(解析版) 题型:解答题
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com