
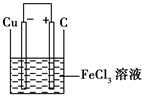


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:不详 题型:填空题
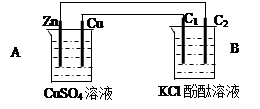
查看答案和解析>>
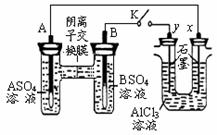
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度越高,金属腐蚀速率越快 |
| B.在铁管外壁上镀锌可防止其被腐蚀 |
| C.金属被腐蚀的本质是金属发生了氧化反应 |
| D.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
| B.埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀 |
| C.钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-e-= Fe3+ |
| D.在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
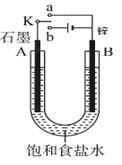
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
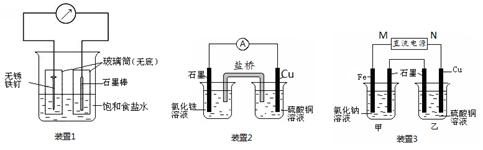
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com