
 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O. 分析 (1)化学反应焓变=反应物键能总和-生成物键能总和计算,CO的燃烧热△H2=-283kJ•moL-1,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,根据表中数据以及盖斯定律来计算;
(2)A.催化剂改变反应途径,降低反应活化能;
B.不同物质表示的正、逆反应速率之比等于化学计量数之比时,反应达到平衡状态;
C.当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变;
D.v=$\frac{△c}{△t}$据此进行计算;
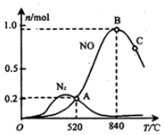
(3)①根据生成物氮气、NO的物质的量判断催化剂对反应的选择性;
②520℃平衡时n(NO)=n(N2)=0.2mol,利用方程式计算两个反应消耗的氨气、氧气物质的量以及生成的水的物质的量,可以计算平衡时氨气与氧气物质的量,由于容器体积为1L,利用物质的量代替浓度带入K=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$计算;
③达到平衡后升高温度NO的物质的量减少,说明平衡逆向移动,则为放热反应;
④C的温度较高,抑制平衡正向移动;
(4)由信息“25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用”可知,NH2OH失去电子数等于高锰酸钾得到电子数,以此来计算.
解答 解:(1)焓变=反应物键能总和-生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ•moL-1,CO的燃烧热△H2=-283kJ•moL-1,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-①得到2CO(g)+2NO(g)?N2(g)+2CO2(g),所以2CO(g)+2NO(g)?N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ•moL-1=-749kJ•moL-1,
故答案为:+183 kJ•moL-1;-749kJ•moL-1;
(2)A.加入催化剂,改变反应途径,降低反应的活化能,增加了活化分子百分数,化学反应速率增大,故A正确;
B.对于反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),应是 6v 正(NH3)=4v 逆(H2O)时,反应达到平衡状态,故B错误;
C.当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,因破坏常数未知,则 $\frac{n(NO)}{n(N{H}_{3})}$=1 不能确定是否平衡,故C错误;
D.4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g),V(NH3)=$\frac{(1-0.12)mol/L}{10min}$=0.088mol•L-1•min-1,据方程式NH3和NO前系数相等,则反应速率也相等,故υ(NO)=0.088mol•L-1•min-1,故D正确,
故答案为:AD;
(3)①由图可知,该催化剂在高温时,生成的NO物质的量远大于氮气的,故该催化剂在高温下选择反应I,
故答案为:I;
②在 1L 密闭容器中充入 1mol NH3和 2mol O2,520℃平衡时n(NO)=n(N2)=0.2mol,则:
4NH3(g)+5O2?4NO(g)+6H2O(g)
变化(mol ):0.2 0.25 0.2 0.3
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)
变化(mol ):0.4 0.3 0.2 0.6
故平衡时,n(NH3)=1mol-0.2mol-0.4mol=0.4mol,n(O2)=2mol-0.25mol-0.3mol=1.45mol,n(H2O)=0.3mol+0.6mol=0.9mol,由于容器体积为1L,利用物质的量代替浓度计算平衡常数K=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$,
故答案为:$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$;
③达到平衡后升高温度NO的物质的量减少,说明平衡逆向移动,则为放热反应,可知△H<0,故答案为:<;
④正反应放热,升高温度平衡逆向移动,则C的温度较高,抑制平衡正向移动,NO的物质的量较少,故答案为:升高温度平衡逆向移动;
(4)羟胺的电子式为 ,由25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用可知,
,由25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用可知,
NH2OH失去电子数等于高锰酸钾得到电子数,
设羟胺的氧化产物中N元素的化合价为x,
由电子守恒可知,25.00×0.001L×0.049mol/L×(x+1)=24.50×0.001L×0.020mol/L×(7-2),
解得x=1,羟胺的氧化产物是N2O,
故答案为: ;N2O.
;N2O.
点评 本题考查反应热计算、化学平衡状态及其影响因素、对图象的分析问题、化学平衡常数计算等,属于拼合型题目,是高考热点题型,平衡常数计算为易错点,题目有利于培养学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气在自然界中既有化合态,也有游离态 | |
| C. | 氯气不能溶于水,可以用排水法收集氯气 | |
| D. | 铁在足量氯气中燃烧生成氯化亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素中的两种或三种只能生成2种18电子的分子 | |
| B. | Z2X4可作为火箭发动机的燃料 | |
| C. | WX2中只含离子键 | |
| D. | Z的氢化物比Y的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt周围的pH降低 | |
| B. | 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA | |
| C. | 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O | |
| D. | 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ④⑤⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
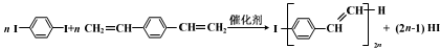
| A. | PPV 是聚苯乙烯 | |
| B. | PPV 难溶于水,易溶于乙醇等有机溶剂 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 1mo  最多可与5molH2发生反应 最多可与5molH2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Q>W | |
| B. | X、Y对应的简单离子的氧化性:Xm+>Yn+ | |
| C. | Q和Z所形成的分子空间构型为直线形 | |
| D. | Q和W可形成原子个数比为1:1和2:1的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com