
某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时c(OH-)为 ;若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1则溶液中c(OH-)为 ,由水电离产生的c(H+)为 ,此时温度_____(填“高于”、“低于”或“等于”)25℃。
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
在下列物质中选择溶于水后可以电离的物质,并写出相应的电离方程式(有几个写几个):
①硝酸铵(NH4NO3) ②葡萄糖[C6H12O6]③氢氧化钡[Ba(OH)2]④硫酸(H2SO4) ⑤四氯化碳(CCl4)
NH4NO3=NH4++NO3﹣
Ba(OH)2=Ba2++2OH﹣
H2SO4=2H++SO42﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B、C、D、E五种有机物的有关信息:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为
|
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
A~E中,属于烃的是 (填字母)。
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
C催化氧化生成D的化学方程式为 。
有机物B具有的性质是 (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)  pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)= n /m [v(A)]
A.①② B.②③④ C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C(s)+CO2(g) == 2CO(g) △H>0, 反应速率为 ,
,
Zn(s)+2HCl(aq)== ZnCl2 (aq)+H2(g) H<0,反应速率为
H<0,反应速率为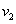 ,
,
对于上述反应,当温度升高时, 和
和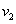 的变化情况为
的变化情况为
A.同时增大 B.同时减小 C. 增大
增大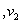 减小 D.
减小 D. 减小
减小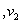 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮是一种有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是( )
A. 蒸发 B. 分液 C.过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数是多少?
②混合后的溶液的物质的量浓度为多少?
(2)在标准状况下,1 L水溶解了一定体积的NH3,所得溶液的密度为ρ g·cm-3,物质的量浓度为a mol·L-,则所溶解的NH3的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属的冶炼,叙述错误的是( )
|
| A. | 活泼金属钠用电解法冶炼 | B. | 用火法或湿法均可制备铜 |
|
| C. | 金属镁只能用热还原法制备 | D. | 铁的冶炼可以用铝热法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com