
| A、0.3mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、该反应的平衡常数表达式K=
| ||
| B、若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态 | ||
| C、若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | ||
| D、若初始时投入4.64g Fe3O4与一定量H2,反应达平衡时容器内固体共有4g,则Fe3O4的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
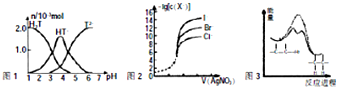
| A、常温下,向20mL 0.1mol?L-1酒石酸(H2T)溶液中添加0.1mol?L-1 NaOH溶液,有关微粒的物质的量与混合溶液的pH关系如图1,则H2T的酸性比H2CO3强 |
| B、用0.0100mol?L-1硝酸根标准溶液,滴定浓度均为0.100mol?L-1的Cl、Br及I的混合溶液,由图2曲线可确定首先沉淀的是Cl- |
| C、碳酸氢钠溶液中存在:c(H+)+2c(H2CO3)=c(OH-)+2c(CO32-) |
| D、由图3可说明烯烃与H2加成反应,虚线表示在催化剂的作用下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3和KHCO3 |
| B、Na2CO3和NaHCO3 |
| C、Na2CO3和K2CO3 |
| D、Na2CO3和CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,电池内部Li+由正极向负极移动 |
| B、每转移0.4 mol电子,有2.8 g Si发生转化 |
| C、放电时负极得电子,质量减轻 |
| D、充电时,阳极的反应式为LiNiO2-e-═NiO2+Li+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
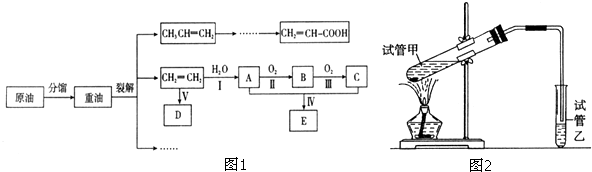
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有分子数为0.5NA |
| B、2 g氢气的体积是22.4L |
| C、在标准状况下,1mol的任何气体的体积都约是22.4L. |
| D、在化学反应中,参加反应的各物质的质量比等于其物质的量的比. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com