
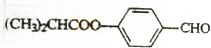
 E的合成路线如下:
E的合成路线如下: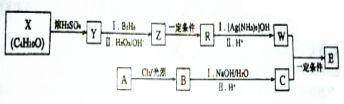
 .X→Y的反应类型是消去反应.
.X→Y的反应类型是消去反应.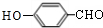 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O
+H2O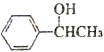 )为原料合成苯乙醛,设计合成路线:
)为原料合成苯乙醛,设计合成路线: $\stackrel{NaOH的醇溶液、加热}{→}$
$\stackrel{NaOH的醇溶液、加热}{→}$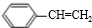 $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$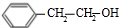 $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$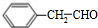 .
. 分析 X分子式为C4H10O,X在浓硫酸作用下反应生成Y,Y能发生题给信息的反应,说明Y中含有碳碳双键,则X为饱和一元醇,Z为饱和一元醇且醇羟基位于边上,Z发生反应生成R,R能发生银镜反应,则R为醛基,所以Z发生氧化反应生成R,R发生银镜反应然后酸化得到W为羧酸,根据E结构简式知,W为(CH3)2CHCOOH,则R为(CH3)2CHCHO、Z为(CH3)2CHCH2OH、Y为(CH3)2C=CH2,且X核磁共振氢谱上有两组峰,则X为(CH3)3COH;
芳香化合物A的分子式C7H8O,苯环上的一氯代物只有2种,A为 ,A发生取代反应生成B,B 的核磁共振氢谱上峰的面积比为1:2:2:1,则B为
,A发生取代反应生成B,B 的核磁共振氢谱上峰的面积比为1:2:2:1,则B为 ,B发生水解反应然后酸化得C,结合题给信息知,C为
,B发生水解反应然后酸化得C,结合题给信息知,C为 ,W和C发生酯化反应生成E,
,W和C发生酯化反应生成E,
(6)1-苯基乙醇( )发生消去反应生成苯乙烯,苯乙烯$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$苯乙醇,苯乙醇发生催化氧化反应生成苯乙醛.
)发生消去反应生成苯乙烯,苯乙烯$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$苯乙醇,苯乙醇发生催化氧化反应生成苯乙醛.
解答 解:X分子式为C4H10O,X在浓硫酸作用下反应生成Y,Y能发生题给信息的反应,说明Y中含有碳碳双键,则X为饱和一元醇,Z为饱和一元醇且醇羟基位于边上,Z发生反应生成R,R能发生银镜反应,则R为醛基,所以Z发生氧化反应生成R,R发生银镜反应然后酸化得到W为羧酸,根据E结构简式知,W为(CH3)2CHCOOH,则R为(CH3)2CHCHO、Z为(CH3)2CHCH2OH、Y为(CH3)2C=CH2,且X核磁共振氢谱上有两组峰,则X为(CH3)3COH;
芳香化合物A的分子式C7H8O,苯环上的一氯代物只有2种,A为 ,A发生取代反应生成B,B 的核磁共振氢谱上峰的面积比为1:2:2:1,则B为
,A发生取代反应生成B,B 的核磁共振氢谱上峰的面积比为1:2:2:1,则B为 ,B发生水解反应然后酸化得C,结合题给信息知,C为
,B发生水解反应然后酸化得C,结合题给信息知,C为 ,W和C发生酯化反应生成E,
,W和C发生酯化反应生成E,
(1)R为(CH3)2CHCHO,R的化学名称为2-甲基丙醛,故答案为:2-甲基丙醛;
(2)B的结构简式为 ,X→Y的反应类型是消去反应,故答案为:
,X→Y的反应类型是消去反应,故答案为: ;消去反应;
;消去反应;
(3)①R与银氨溶液反应方程式为 (CH3)2CHCHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$(CH3)2CHCOONH4+2Ag↓+3NH3+H2O,
故答案为:(CH3)2CHCHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$(CH3)2CHCOONH4+2Ag↓+3NH3+H2O;
②W为(CH3)2CHCOOH,C为 ,W和C发生酯化反应生成E,反应方程式为:(CH3)2CHCOOH+
,W和C发生酯化反应生成E,反应方程式为:(CH3)2CHCOOH+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:(CH3)2CHCOOH+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;
+H2O;
(4)X为(CH3)3COH,T是X的同系数,T的相对分子质量比X大14,则T中碳原子个数比X多1个,T中含有5碳原子,T发生催化氧化生成的醛的醇有1-戊醇、2-甲基-1-丁醇、3-甲基-1-丁醇、2,2-二甲基-1-丙醇,所以有4种,故答案为:4;
(5)Y为(CH3)2C=CH2,碳碳单键可以旋转,结合乙烯分子结构知,Y的分子中,最多有8个原子共平面,故答案为:8;
(6)1-苯基乙醇( )发生消去反应生成苯乙烯,苯乙烯$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$苯乙醇,苯乙醇发生催化氧化反应生成苯乙醛,其合成路线为
)发生消去反应生成苯乙烯,苯乙烯$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$苯乙醇,苯乙醇发生催化氧化反应生成苯乙醛,其合成路线为 $\stackrel{NaOH的醇溶液、加热}{→}$
$\stackrel{NaOH的醇溶液、加热}{→}$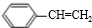 $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$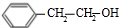 $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$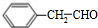 ,
,
故答案为: $\stackrel{NaOH的醇溶液、加热}{→}$
$\stackrel{NaOH的醇溶液、加热}{→}$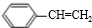 $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$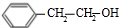 $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$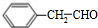 .
.
点评 本题考查有机物推断和有机合成,为高频考点,侧重考查学生分析推断及综合知识运用能力,正确判断X结构简式是解本题关键,根据E结构简式采用正逆结合的方法进行推断,难点是(4)同分异构体种类判断及(6)题合成路线设计,题目难度中等.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度(℃) | Na2S2O3浓度(mol/L) | HCl浓度(mol/L) |
| A. | 10 | 0.1 | 0.1 |
| B. | 10 | 0.2 | 0.2 |
| C. | 20 | 0.1 | 0.1 |
| D. | 20 | 0.2 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制).
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为: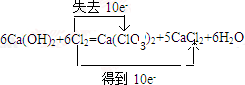 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卫星上的太阳能电池工作 | |
| B. | 向氢氧化铁胶体中加入稀硫酸产生红褐色沉淀 | |
| C. | 向鸡蛋清中加入饱和硫酸铵溶液,产生白色沉淀 | |
| D. | 向盛有红墨水的试管中加入活性炭,振荡,红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丙烷的所有碳原子可能处于同一平面 | |
| B. | 一定条件下,Cl2可在甲苯(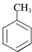 )的苯环或侧链上发生取代反应 )的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯(C3H6)的物质的量各1mol,完全燃烧都是生成3mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Cl2反应其一氯代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4固体 | B. | H2O | C. | 少量CuSO4溶液 | D. | 4 mol/L H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com