
分析 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.3mol,说明有机物含有3个C原子、6个H原子,该烃能使溴水褪色,说明含有碳碳双键,应为烯烃,以此解答该题.
解答 解:n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.3mol:0.3mol×2=1:3:6,即1个分子中含有3个C原子、6个H原子,故该烃的分子式为:C3H6,该烃能使溴水褪色,说明含有碳碳双键,应为烯烃,即丙烯,可与溴水发生加成反应,方程式为CH3CH=CH2+Br2→CH3CHBrCH,
故答案为:C3H6;CH3CH=CH2+Br2→CH3CHBrCH;加成反应.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意明确质量守恒在确定有机物分子式中的应用.


科目:高中化学 来源: 题型:实验题
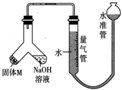 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
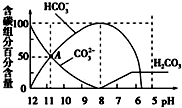
| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: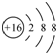 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 二氧化碳分子的电子式: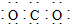 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
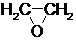 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH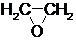 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.| C2H4 | O2 | N2 |  | |
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
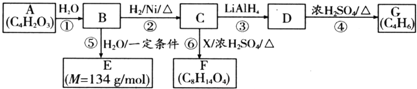
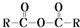 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH 、
、 .
.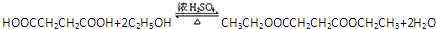 .
.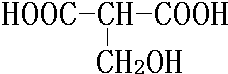 、
、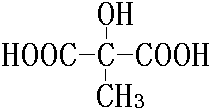 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com