
 ;BeO与氢氧化钠反应生成BeO22-和H2O,其离子方程式为:BeO+2OH-=BeO22-+H2O;
;BeO与氢氧化钠反应生成BeO22-和H2O,其离子方程式为:BeO+2OH-=BeO22-+H2O; ;BeO+2OH-=BeO22-+H2O;
;BeO+2OH-=BeO22-+H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
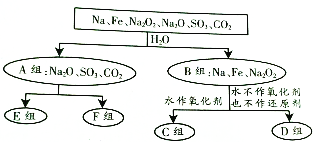
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
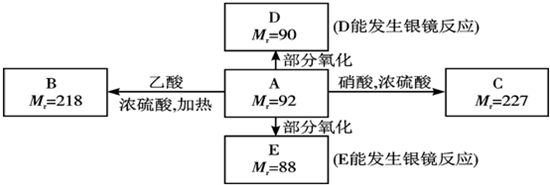
查看答案和解析>>
科目:高中化学 来源: 题型:
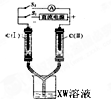 X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:
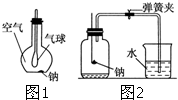 (1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到
(1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 加入的试剂 | 作用 |
| 1 | ||
| 2 | ||
| 3 | ||
| … | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在棕色细口瓶中 |
| B、液溴用水封保存 |
| C、少量金属钠保存在煤油中 |
| D、烧碱溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com