
 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题: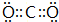 或
或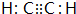 (任写一种).
(任写一种).分析 A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;B原子核外电子有6种不同运动状态,则B为碳元素;A、D、E三种元素的原子序数之和为25,则D、E原子序数之和25-1=24,D与C、E均相邻,由原子序数奇偶性可知D、E不能同周期,故二者同族,不能是三、四周期元素,因为同族相邻原子序数之和最小为11+19=30,可推知D为O元素、E为S元素,则C为N元素;G的质子数是25,则G为Mn;E2-和F+有相同的核外电子排布,则E为S元素、F为K元素.
解答 解:A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;B原子核外电子有6种不同运动状态,则B为碳元素;A、D、E三种元素的原子序数之和为25,则D、E原子序数之和25-1=24,D与C、E均相邻,由原子序数奇偶性可知D、E不能同周期,故二者同族,不能是三、四周期元素,因为同族相邻原子序数之和最小为11+19=30,可推知D为O元素、E为S元素,则C为N元素;G的质子数是25,则G为Mn;E2-和F+有相同的核外电子排布,则E为S元素、F为K元素.
(1)G的质子数是25,外围电子排布式为:3d54s2,B、C、D三种元素分别形成的最简单氢化物分别为甲烷、氨气、水,常温下水为液态,而甲烷、氨气为气态,故水的沸点最高,
故答案为:3d54s2;H2O;
(2)氧元素的同素异形体有O2、O3,由上述元素中的两种元素组成的一种阴离子与D的一种同素异形体分子互为等电子体,该阴离子化学式为NO2-,
故答案为:NO2-;
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒有CO2、C2H2,电子式为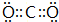 、
、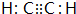 ,
,
故答案为: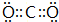 或
或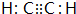 ;
;
(4)M是由4个N原子组成的一种不稳定的多原子单质分子,M分子中N原子杂化方式为sp3杂化,类似白磷的结构,即M分子的立体构型为正四面体,
故答案为:正四面体;
(5)某一次性电池的负极材料是Zn,正极材料是G的一种常见氧化物(MnO2),电解质是KOH.该电池的正极反应式为:MnO2+e-+H2O═MnOOH+OH-,
故答案为:MnO2+e-+H2O═MnOOH+OH-;
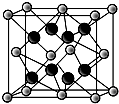
(6)电负性最大的元素是O元素,第一电离能最小的元素是K元素,该晶胞中白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数=8,所以黑色和白色球个数之比为2:1,其化学式为K2O,离子晶体中晶格能与电荷成正比、与离子半径成正比,钙离子电荷数大于钾离子、半径小于钾离子,所以晶格能较小的是K2O,
所以白色球表示氧离子、黑色球表示钾离子,晶胞质量为4×$\frac{39×2+16}{{N}_{A}}$g,晶胞的边长为a×10-10cm,晶胞体积=(a×10-10cm)3,密度ρ=4×$\frac{39×2+16}{{N}_{A}}$g÷(a×10-10cm)3=$\frac{94×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:K2O; $\frac{94×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、原电池原理、等电子体、核外电子排布、分子结构与性质等知识点,同时考查学生分析问题、解决问题能力,需要学生具备扎实的基础,是对基础知识的综合考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: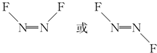 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
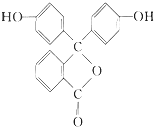
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
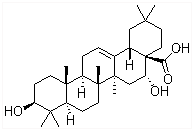 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
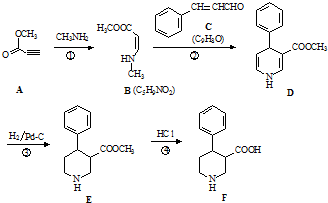
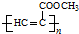 .
.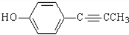 .
.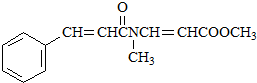 .
.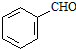 、CH3CH2OH和
、CH3CH2OH和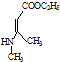 为原料,合成
为原料,合成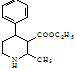 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).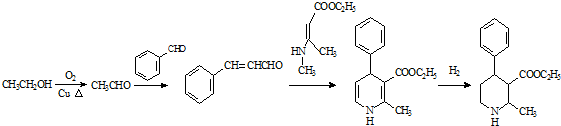
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
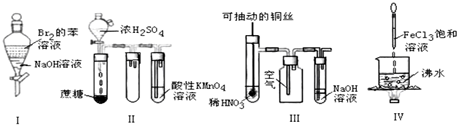
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
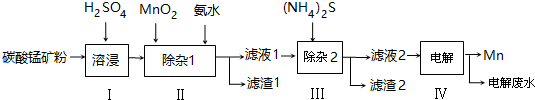
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com