
| A. | 食盐 | B. | 油脂 | C. | 氨基酸 | D. | 蛋白质 |
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
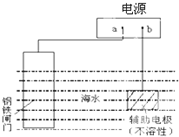
| A. | 图所示是牺牲阳极阴极保护法 | |
| B. | a为电源正极 | |
| C. | 电子流向:a→铁闸门,辅助电极→b | |
| D. | 辅助电极上的反应:O2+2H2O+4e→4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的物质的量为4.5mol的状态为平衡状态 | |
| B. | O2的平均反应速率为0.4amol•(L•min)-1 | |
| C. | SO2和O2的反应百分率相等 | |
| D. | 达到化学平衡状态时容器内压强减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO32-)=0.5 mol•L-1的溶液中:ClO-、Na+、Cl-、CO32- | |
| B. | pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ | |
| C. | 强碱性溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 水电离产生的c(H+)=1×10-14mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com