
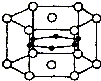
 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
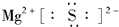 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
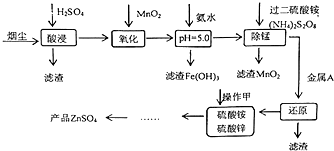 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O与互为同位素 | |
| B. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O间的相互转化 | |
| D. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2含有相同的氧原子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NH3)=0.6mol/(L•S) | B. | V(O2)=0.7mol/(L•S) | C. | V(NO)=0.5mol/(L•S) | D. | V(H2O)=0.8mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氯气:K+、Fe2+、SO42-、Br- | |
| B. | 通入SO2:Ba2+、NH4+、NO3-、Cl- | |
| C. | 加入氧化钠固体:Mg2+、HCO3-、SO42- | |
| D. | 透明溶液中:Cu2+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池是二次电池 | |
| B. | 铜片、锌片、导线和甜橙组成的水果电池,负极是铜片 | |
| C. | 铅蓄电池的放电过程,从能量转换形式看是化学能转化为电能 | |
| D. | 原电池工作时溶液中的阳离子移向负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com