
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下:

金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:

当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
A.反应中发生转移的电子个数为3nx
B.该废水中c(Cr2O2-7)为50nx mol/L
C.消耗硫酸亚铁铵的物质的量为n(l+y)mol
D.在FeO·FeyCrxO3中,x+y=2
(14分)
(1)Cr2O2-7 ;灰绿色;3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O;
(2)①电解时阴极消耗H+,Cr2O2-7还原为Cr3+ 也消耗H+,所以pH不断上升;
②3.7<pH< 8.5;③0.25 mol;④A
【解析】
试题分析:
(1)因为在强酸性溶液中;2CrO42-+2H+ Cr2O72-+H2O平衡向右移动;
Cr2O72-+H2O平衡向右移动;
Cr2O2-7与C2H5OH反应生成Cr3+ 所以呈灰绿色;
根据氧化还原反应配平得 3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O;
(2)①电解时阴极的电极反应方程式为2H+ +2e=H2 另外溶液中还发生Cr2O72- +6 Fe2++14 H+ = 2Cr3+
+6 Fe3+ +7 H2O
②3.7<pH<8.5,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀;
③当电路中通过3mol电子时,会产生1.5mol Fe2+ ,再根据Cr2O72- +6 Fe2++14 H+ = 2Cr3+ +6 Fe3+ +7 H2O还原的Cr2O72- 为0.25mol ;
④反应中发生转移的电子个数为ny;
考点:本题以探究实验为基础,考察学生对氧化还原反应的掌握情况。


科目:高中化学 来源: 题型:

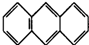 ,平面结构)属于
,平面结构)属于查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第三轮复习质量检测理综化学试卷(解析版) 题型:填空题
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致
发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等。
(1)Mn2+在基态时,核外电子排布式为_________。
(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为________个。

(3)蒽(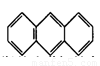 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。
(4)8一羟基喹啉铝具有较高的发光效率。8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有_______(填字母)。
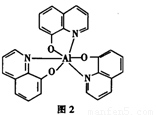
A.极性键 B.非极性键 C.金属键 D.氢键 E.配位键
(5)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图3所示。下列说法正确的是________(填字母)。
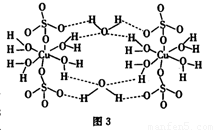
A.在上述结构示意图中,所有氧原子都采用SP3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为_______。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C+____K2Cr2O7+ ____ → _____CO2↑+_____K2SO4 + ____ Cr2(SO4)3+____H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是_________;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:  △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为 ___________ ;
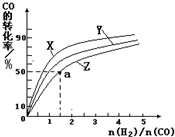
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

 CH3OH(g)的平衡常数K =___________ 。
CH3OH(g)的平衡常数K =___________ 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com