
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):
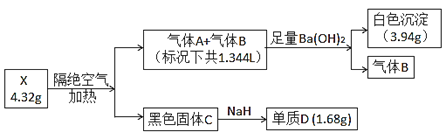
已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。根据上述信息,回答下列问题:
(1)盐X的化学式为________________。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式___________________。
(3)将产生的气体A全部被100 mL 0.35 mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____________________。
【答案】FeC2O4 Fe3O4+4NaH =3Fe +4NaOH 4CO2+7OH—=3CO32—+HCO3—+3H2O
【解析】
固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属,且D和NaH反应得到D,则D为Fe,C为Fe3O4;气体A和气体B所含元素相同,都是无色无味气体,且将这两种气体通入到足量的Ba(OH)2溶液中,产生白色沉淀,B不反应,则A为CO2,B为CO;D的质量为1.68g,则4.32g X含Fe的物质的量为0.03mol,受热分解产生0.01mol Fe3O4;白色沉淀BaCO3的质量为3.94g,则根据碳元素守恒可以得知,n(CO2)=![]() =0.02mol;X受热分解产生的CO、CO2的体积为1.344L(标况),则n(CO)+n(CO2)=
=0.02mol;X受热分解产生的CO、CO2的体积为1.344L(标况),则n(CO)+n(CO2)=![]() =0.06mol,故n(CO)=0.04mol;综上所述,4.32g X经隔绝空气加热分解产生0.01mol Fe3O4、0.02mol CO2、0.04mol CO,则4.32g X含0.03mol Fe、0.06mol C、0.12mol O,故X的化学式为FeC2O4。
=0.06mol,故n(CO)=0.04mol;综上所述,4.32g X经隔绝空气加热分解产生0.01mol Fe3O4、0.02mol CO2、0.04mol CO,则4.32g X含0.03mol Fe、0.06mol C、0.12mol O,故X的化学式为FeC2O4。
(1)经分析,X的化学式为FeC2O4;
(2)根据题中的信息,可以推出该反应的化学方程式为:Fe3O4+4NaH=3Fe+4NaOH;
(3)经分析,气体A(CO2)的物质的量为0.02mol,n(NaOH)=0.1L× 0.35mol·L-1=0.035mol,
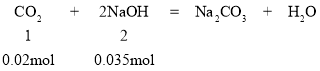
则CO2过量,即该过程涉及两个化学反应:CO2+2NaOH=Na2CO3+H2O,CO2+Na2CO3+H2O=2NaHCO3,从量上0.035nol NaOH和0.0175mol CO2反应生成0.0175mol Na2CO3,接着剩余的0.0025mol CO2消耗0.0025mol Na2CO3生成0.005mol NaHCO3,Na2CO3还剩0.015mol,所以0.02mol CO2和0.035mol NaOH反应生成了0.015mol Na2CO3、0.005mol NaHCO3,故该反应的化学方程式为:4CO2+7NaOH=3Na2CO3+NaHCO3+3H2O,离子方程式为:4CO2+7OH-=3CO32-+HCO3-+3H2O。


科目:高中化学 来源: 题型:
【题目】实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:
Ⅰ.制备NaClO强碱性饱和溶液:
①将20 mL NaOH溶液加入仪器b中,冷水浴冷却,通入Cl2,搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20 g NaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
(1)甲装置中a管的作用是_____________________________________________。
(2)写出甲装置中反应的化学方程式_____________________________________。
(3)石灰乳的作用是___________________________________________________。
(4)反应过程中用冷水浴冷却的原因是___________________________________。
Ⅱ.合成K2FeO4:
①称取5.05 g Fe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5 min,过滤,得K2FeO4(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13 g。
(5)合成Na2FeO4的离子方程式为____________________________________。
(6)过程③加入饱和KOH溶液即可得到K2FeO4粗产品,原因是__________。
(7)用异丙醇洗涤的目的是__________________________________________。
(8)K2FeO4的产率为___________(保留至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是( )
A.K2SO3是否被氧化(BaCl2溶液)B.新制氯水已经完全变质(紫色石蕊试液)
C.KI是否被氧化(淀粉溶液)D.FeSO4是否被氧化(KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)25℃ 101 kPa时,氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为____。
(2)若1g水蒸气转化为液态水放热2.444 kJ,则反应2H2(g)+O2(g)=2H2O(l)的ΔH=___,由此可知氢气的燃烧热为____。(结果保留小数点后一位)
Ⅱ.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关中和反应的问题:
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出___kJ的能量。
(2)如图所示装置中,仪器A的名称是___,作用是__;碎泡沫塑料的作用是___。
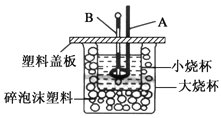
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是___。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
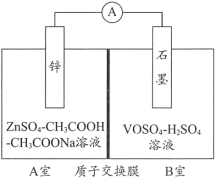
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2CH2CH3(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+![]() O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
A.正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com