
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | (2a-3.2)g |
分析 CuO和Fe2O3的混合物与硝酸反应生成硝酸盐和水,CuO~Cu(NO3)2,Fe2O3~Fe(NO3)3,由电荷守恒可知:2n混合物(O)=n(NO3-),据此计算2ag混合物中氧元素的质量,用足量CO还原2a g混合物,反应剩余固体为Cu、Fe,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:CuO和Fe2O3的混合物与硝酸反应生成硝酸盐和水,CuO~Cu(NO3)2,Fe2O3~Fe(NO3)3,由电荷守恒,可知ag混合物中2n混合物(O)=n(NO3-)=0.2 L×1 mol/L,则n混合物(O)=0.1mol,故2ag混合物中氧元素的质量为0.1mol×2×16g/mol=3.2g,用足量CO还原2a g混合物,反应剩余固体为Cu、Fe,则金属质量为氧化物的质量减去氧的质量,即金属质量为:2ag-3.2g=2(a-1.6)g,
故选B.
点评 本题考查混合物的计算,难度中等,确定金属氧化物中O氧原子物质的量与硝酸的物质的量关系是解答该题的关键,也可以根据酸与氧化物生成水计算氧元素质量.


科目:高中化学 来源: 题型:填空题
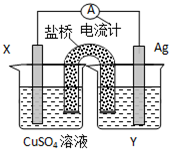 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①点所示溶液中:c(A-)+c(OH-)=c(HA)+c(H+) | |
| B. | ②点所示溶液中:c(Na+)>c(HA)>c(A-)>c(H+)>c(OH-) | |
| C. | ②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| D. | ③点所示滴入的NaOH溶液的体积V>20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2(CaO):HCl | B. | MgO(Al2O3):NaOH | C. | CO2(SO2):Ca(OH)2 | D. | NaCl(NH4Cl):加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电路中流过0.05mol电子 | B. | 溶液中c(Cu2+)降低 | ||
| C. | 电解质溶液质量减少 | D. | 阳极铜消耗了1.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com