
| A.达到化学平衡状态时,容器中将生成2molNH3 |
| B.t分钟后,只要条件不变,容器内各气体的浓度就不再变化 |
| C.达到化学平衡状态时,v(N2)=v(H2)=v(NH3) |
| D.达到化学平衡状态时,正反应和逆反应的速率相等,且均等于0 |
科目:高中化学 来源:不详 题型:单选题
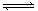 pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是 ( )
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是 ( ) | A.m + n>p | B.平衡向正反应方向移动 |
| C. A的转化率降低 | D. C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

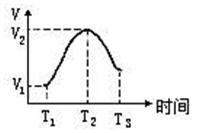
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
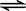 2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是| A.容器内每减少1mol A2,同时消耗2mol AB3 |
| B.容器内nA2:nB2:nAB3=1:3:2 |
| C.混合气体总的物质的量 |
| D.容器内的气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业采用高温条件 |
| B.配制FeSO4溶液时在溶液中加入稀硫酸 |
| C.H2、I2、HI 平衡混合气体加压后颜色变深 |
| D.工业制硫酸中,SO2氧化成SO3,往往需使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B(g),下列各项中,表示已达到平衡的是:
B(g),下列各项中,表示已达到平衡的是:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
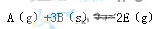 ,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E| A.①③⑥ | B.②③⑥ | C.②④⑥ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 △H=akJ/mol.
△H=akJ/mol. △H=bkJ/mol,
△H=bkJ/mol,| T/K | K1 | K2 | ||||
| 973 | 1.47 | 2.38 | ||||
| 1173 | 2.15 | 1.67
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |