
 nW(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图: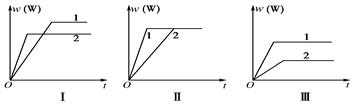
| A.图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且Ⅰ使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 |
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:不详 题型:填空题
 B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。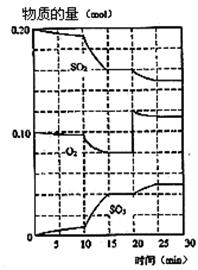
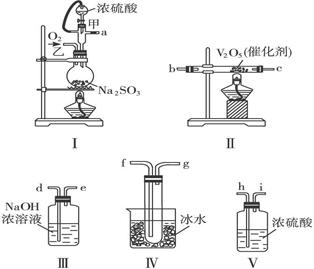
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是| A.单位时间生成 n 摩尔的A2同时生成 n 摩尔的AB |
| B.容器内的总压不随时间变化 |
| C.单位时间生成 2n 摩尔的AB同时生成 n 摩尔的B2 |
| D.单位时间生成 n 摩尔的A2同时生成 n 摩尔的B2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CH3OH(气),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,求:(1)H2的反应速率;(2)CO的转化率;(3)求相同条件下CH3OH(气)
CH3OH(气),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,求:(1)H2的反应速率;(2)CO的转化率;(3)求相同条件下CH3OH(气)  2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
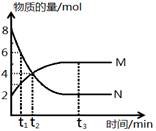
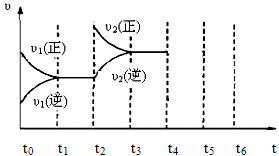
A.反应的化学方程式为:2M N N |
| B.t3时,正逆反应速率相等 |
| C.t2时,N的消耗速率大于N的生成速率 |
| D.t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 WI2(g)ΔH<0
WI2(g)ΔH<0| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com