
【题目】有机物 G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。
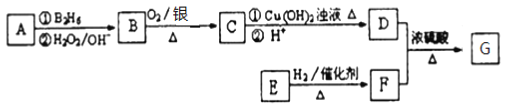
已知:(1) ![]()
(2) 有机物A属于烃类,其相对分子质量为56,核磁共振氢谱有2组峰
(3) E能发生银镜反应,1molE与2molH2可以发生反应生成F
(4)有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下面的问题:
(1)有机物B:____________,反应E→F的反应类型为:____________;
(2)E的结构简式为____________:
(3)A在一定条件下生成高分子化合物的化学方程式为____________;
(4)D+F→G 的化学方程式:____________;
(5)已知有机化合物甲符合下列条件:①芳香族化合物②与F互为同分异构体③能被催化氧化成醛。符合上述条件的有机物甲有____________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰的有机物的结构简式为(写出符合条件的其中一种即可)____________ 。
【答案】(1)2-甲基-1-丙醇 加成反应(或还原反应) (2)C6H5-CH=CHCHO
(3)![]()
(4)(CH3)2CHCOOH +C6H5-CH2CH2CH2OH![]() (CH3)2CHCOOCH2CH2CH2-C6H5 +H2O
(CH3)2CHCOOCH2CH2CH2-C6H5 +H2O
(5)13 种 
【解析】
试题分析:有机物A属于烃类,其相对分子质量为56,分子式为C4H8,核磁共振氢谱有2组峰,则A为CH3CH=CHCH3或(CH3)2C=CH2,A发生信息中的反应生成B,B可以连续发生氧化反应,A的核磁共振氢谱有2组峰,则A为(CH3)2C=CH2,B的结构简式为(CH3)2CHCH2OH,C的结构简式为(CH3)2CHCHO,有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链,结合G的分子式可知F的结构简式为:![]() ,则G为
,则G为![]() ,E能发生银镜反应,在一定条件下1molE能与2molH2反应生成F,则E为
,E能发生银镜反应,在一定条件下1molE能与2molH2反应生成F,则E为![]() ;
;
(1)B的结构简式为(CH3)2CHCH2OH,由![]() 生成
生成![]() 的反应类型为加成反应或还原反应;
的反应类型为加成反应或还原反应;
(2)E的结构简式为![]() :
:
(3)(CH3)2C=CH2在一定条件下生成高分子化合物的化学方程式为![]() ;
;
(4)D+F→G的化学方程式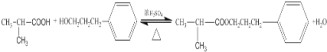 ;
;
(5)已知有机物甲符合下列条件:①为芳香族化合物,说明含有苯环;②与F(![]() )互为同分异构体;③能被催化氧化成醛,含有-CH2OH结构,含有一个取代基为-CH(CH3)CH2OH,含有2个取代基为-CH3、-CH2CH2OH或者-CH2CH3、-CH2OH,各有邻、间、对3种,含有3个取代基为2个-CH3和-CH2OH,2个-CH3处于邻位,-CH2OH有2种位置,2个-CH3处于间位,-CH2OH有3种位置,2个-CH3处于对位,-CH2OH有1种位置,符合上述条件的有机物甲有13种,其中一种苯环上有3个侧链,且核磁共振氢谱有5组峰的有机物的结构简式:
)互为同分异构体;③能被催化氧化成醛,含有-CH2OH结构,含有一个取代基为-CH(CH3)CH2OH,含有2个取代基为-CH3、-CH2CH2OH或者-CH2CH3、-CH2OH,各有邻、间、对3种,含有3个取代基为2个-CH3和-CH2OH,2个-CH3处于邻位,-CH2OH有2种位置,2个-CH3处于间位,-CH2OH有3种位置,2个-CH3处于对位,-CH2OH有1种位置,符合上述条件的有机物甲有13种,其中一种苯环上有3个侧链,且核磁共振氢谱有5组峰的有机物的结构简式:![]() 。
。


科目:高中化学 来源: 题型:
【题目】按下列要求,回答问题:
Ⅰ.右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
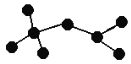
(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)M是由某烯烃加成生成的产物,则该烯烃可能有 种结构。
Ⅱ.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
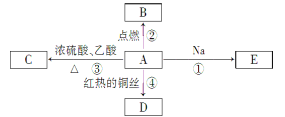
(1)A的名称________;C的分子式为 。
(2)A、C、D有机物中所含官能团名称 。
(3)写出下列反应的化学方程式:
反应①__________________________;
反应③___________________________;
反应④___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钦(TiO2)表面作用使海水分解得到氢气的新技术:![]() 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水光解产物应用于燃料电池的整个过程中完成了能量的转化:____能转变为____能,最后转化 为_______能。
(2)水分解时,断裂的化学键为_____键(填“共价”或“离子”),分解海水的反应属于____反应(填“放热”或“吸热”)。
(3)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2—4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的____极;电子从该极____(填“流入”或“流出”)。
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。该原电池的负极材料是_____,正极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法错误的是
A.pH=3的 NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等
B.25℃时将0.1mol·L -1 的HF加水不断稀释,![]() 不变
不变
C.K2SO3溶液中加入少量NaOH固体,溶液的pH增大,SO32-水解程度减小
D.pH=5的CH3 COOH 与CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的许多金属能形成配合物。科学家通过X射线测得胆矾结构示意图可简单表示如下: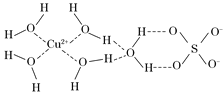
(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是_____________________。
(2)NH3是一种很好的配体,原因是______________________。
(3)图中虚线表示的作用力为________________。
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是__________,写出一种与此正四面体结构互为等电子体的分子的分子式 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
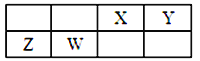
A. 原子半径由小到大的顺序为:X<Z<Y<W
B. Y元素最高价氧化物对应的水化物化学式为H3YO4
C. X、Z两种元素的氧化物中所含化学键类型相同
D. Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
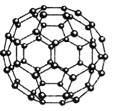
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
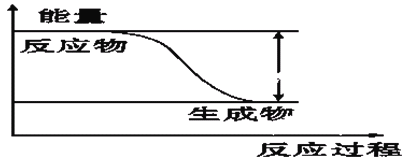
(1)该反应为 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜片上产生的现象为 。溶液中SO42-向 极(填“贴片”或“铜片”),外电路中电子 移动。(填“由铁片向铜片”或“由铜片向铁片”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2可以制造价值更高的化学产品。
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802.0 kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH3=-566.0 kJ·mol-1
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_____________________。
(3)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
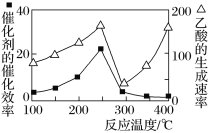
①250~300 ℃时,乙酸的生成速率降低的原因是________________________________。
②300~400 ℃时,乙酸的生成速率升高的原因是________________________________。
(4)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
①当x=5.0时,上述反应向______方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”“小于”或“等于”)。
(5)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组用甲烷燃料电池进行饱和氯化钠溶液电解实验,如图所示:
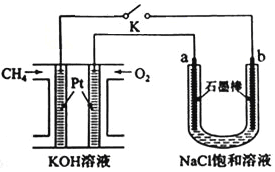
回答下列问题:
若电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为_______ (已知NA=6.02×1023mol-1,电子电荷量为1.60×10-19C,列式表示即可),最多能产生的氯气体积 为_______L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com