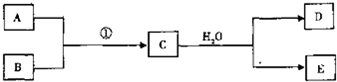
�⣺��1����������Ϊ��ȼ��Ŀǰ60%��B���ǴӺ�ˮ����ȡ�ģ���B��Mg������D����ʹʪ��ĺ�ɫʯ����ֽ��������D��NH
3��C��ˮ��Ӧ���ɰ�����E������Ԫ���غ�֪��A�к��е�Ԫ�أ�Mg�͵����ܷ������ɵ���þ������A�ǵ���������þ��ˮ��Ӧ���ɰ�����������þ�������䷴Ӧ����ʽΪ��Mg
3N
2+6H
2O=3Mg��OH��
2+2NH
3����
������ȼ�ϵ���У������ϰ���ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2NH
3+6OH
--6e
-=N
2��+6H
2O��
�ʴ�Ϊ��Mg
3N
2+6H
2O=3Mg��OH��
2+2NH
3����2NH
3+6OH
--6e
-=N
2��+6H
2O��
��2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C�������������Ƕ�Ԫ�ᣬ�͵����ʵ������������Ʒ�Ӧ�������⻯�ƣ��������ӷ�Ӧ����ʽΪ��H
2S+OH
-=HS
-+H
2O���ʴ�Ϊ��H
2S+OH
-=HS
-+H
2O��
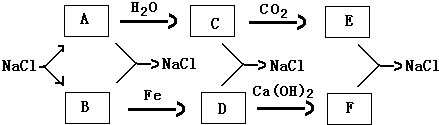
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ����Ӧ����ʽΪ��Fe+6HNO
3��Ũ��

Fe��NO
3��
3+3NO
2��+3H
2O��
������A��B��Ӧ����1molC���ʱ�Ϊ-57.07kJ/mol�����Ȼ�ѧ��Ӧ����ʽΪ��2NO+O
2=2NO
2��H=-114.14kJ/mol�٣�
1molC��H
2O��Ӧ��������D��E��Һ���ʱ�Ϊ-46kJ/mol�����Ȼ�ѧ��Ӧ����ʽΪ3NO
2+H
2O=2HNO
3+NO��H=-138kJ/mol�ڣ�
������ʽ�١�3+�ڡ�2��4NO��g��+3O
2��g��+2H
2O��l��=4HNO
3��aq����H=��-114.14kJ/mol����3+��-138kJ/mol����2=618.42kJ/mol��
�ʴ�Ϊ��Fe+6HNO
3��Ũ��

Fe��NO
3��
3+3NO
2��+3H
2O��4NO��g��+3O
2��g��+2H
2O��l��=4HNO
3��aq����H=-618.42kJ/mol��
��������1����������Ϊ��ȼ��Ŀǰ60%��B���ǴӺ�ˮ����ȡ�ģ���B��Mg������D����ʹʪ��ĺ�ɫʯ����ֽ��������D��NH
3��C��ˮ��Ӧ���ɰ�����E������Ԫ���غ�֪��A�к��е�Ԫ�أ�Mg�͵����ܷ������ɵ���þ������A�ǵ���������þ��ˮ��Ӧ���ɰ�����������þ���ݴ�д����Ӧ����ʽ��
������ȼ�ϵ���У������ϰ���ʧ���ӷ���������Ӧ��
��2����������Ϊ���ȣ�E��һ���������������E����������������D��һ���г�������ζ�����壬��ˮ��Һ�ǻ�ԭ���ᣬ��D�����⣬����Ԫ���غ�֪��C�������������Ƕ�Ԫ�ᣬ�͵����ʵ������������Ʒ�Ӧ�������⻯�ƣ��ݴ�д����Ӧ����ʽ��
��3����������Ϊ���£�B��DΪͬ-����ɫ���壬������E��Ũ��Һ����ʹFe�ۻ�����E�����ᣬD��һ��������C�Ƕ���������A������������Fe�ۺ�Ũ���ᷴӦ����������������������ˮ��
���ø�˹���ɼ��㣮
���������⿼��Ԫ�ػ���������ʣ���ȷ�ƶ������ǽⱾ��ؼ�����ȷ���ʵ��������ʼ��ɽ���Ѷ��еȣ�

 Fe��NO3��3+3NO2��+3H2O��
Fe��NO3��3+3NO2��+3H2O�� Fe��NO3��3+3NO2��+3H2O��4NO��g��+3O2��g��+2H2O��l��=4HNO3��aq����H=-618.42kJ/mol��
Fe��NO3��3+3NO2��+3H2O��4NO��g��+3O2��g��+2H2O��l��=4HNO3��aq����H=-618.42kJ/mol��




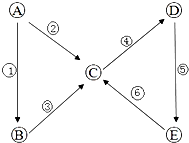 ���¶����������ѧϰ�г��������ʣ��밴��Ҫ��ش�������⣺
���¶����������ѧϰ�г��������ʣ��밴��Ҫ��ش�������⣺