
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | CH4(C2H4) | Br2水 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯与溴水反应,而甲烷不能;
B.苯与溴发生取代反应;
C.硝酸与NaOH反应后,与硝基苯分层;
D.硫化氢与硫酸铜反应生成沉淀,而乙炔不反应.
解答 解:A.乙烯与溴水反应,而甲烷不能,利用洗气可除杂,故A正确;
B.苯与溴发生取代反应,将原物质除去,不能除杂,应选NaOH溶液、分液,故B错误;
C.硝酸与NaOH反应后,与硝基苯分层,则分液可分离,故C正确;
D.硫化氢与硫酸铜反应生成沉淀,而乙炔不反应,利用洗气可分离,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物性质的综合应用,题目难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用贮氢金属和氢气反应生成氢化物的方法,为解决氢气的贮存问题指明了方向 | |
| B. | 科学家发现纳米硒除荧光灯的残汞效果非常好,可见纳米硒的非金属性比一般的硒强 | |
| C. | 在人类对酸碱认识的发展过程中,提出的酸碱质子理论不但适用于水溶液,在非水溶液和无水条件下也适用 | |
| D. | 为了使加酶洗衣粉有良好的洗涤效果,可先用温水溶解洗衣粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的单质的熔点最高 | |
| B. | X元素的非金属性最强 | |
| C. | 最高价氧化物的水化物按酸性增强碱性减弱的顺序是YZWX | |
| D. | Z的原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
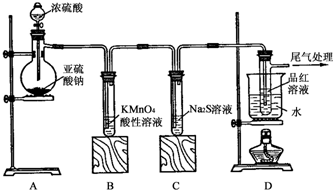
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com