
如下图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡。合金中铁和银的质量比为( )
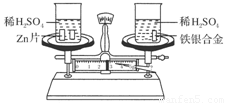
A.65 ∶56 B.56 ∶108
C.56 ∶9 D.65 ∶9
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源:江西省九江一中2011-2012学年高一上学期期中考试化学试题 题型:058
实验室中有一瓶氯化钾和氯化钙的固体混和物,通过下面的实验除去氯化钾中氯化钙,并利用纯净的氯化钾配制一定浓度的氯化钾溶液.根据实验步骤填写下列空白.

回答下列问题
(1)加入的A是________.(填分子式,下同)
(2)操作②的名称是________.操作①、②均要用到的玻璃仪器有________.
(3)B物质是________,加入过量的B反应的离子方程式为________.
(4)称取一定量纯净的KCl,配制一定浓度的氯化钾溶液.
(ⅰ)某同学用托盘天来称取一定质量的KCl,称法如下图所示,天平的指针在标尺中间.此操作是否正确________(填正确或不正确);若按此操作称量,所称KCl的实际质量为________g (已知烧杯的质量为12.9克).

(ⅱ)某学生将准确称量的KCl固体放入烧杯中,加入约30毫升蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100毫升容量瓶中,然后往容量瓶中小心地加蒸馏水,直到液面接近刻度1-2厘米处,改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度相切,把容量瓶盖紧,再振荡摇匀.该生操作中的错误是________和________.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(共13分)〔一〕实验室用氢氧化钠配制1.00mol/L的氢氧化钠溶液0.2L,回答下列问题
(1)下列有关使用托盘天平的叙述,正确的是 。
A.称量前先调节天平的零点。
B.称量时左盘放被称量物,右盘放砝码。
C.氢氧化钠必须放在玻璃器皿里称量。
D.称量时,应先加质量小后加质量大的砝码至天平平衡。
E.称量完毕,应把天平放回砝码盒中。
(2)某同学用托盘天平称取一盛有氢氧化钠药品的烧杯,若左盘上放有30g砝码,游码位置如下图所示,天平的指针指在标尺的中间。则烧杯和粉剂的总质量为_________克。
〔二〕用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀 ,请按要求填空:
(1)如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
(2)第⑤步实验的操作是(文字叙述)_______________________________________________
(3)某学生的下列操作中使浓度偏低的原因是: 。
① 用量筒量取浓硫酸时,俯视读数。
② 量筒中浓硫酸全部转入烧杯中稀释后,再转移到100ml容量瓶中,烧杯未洗涤。
③ 用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面。
④ 浓硫酸在小烧杯中稀释后,没有冷却就马上转移入容量瓶。
⑤ 用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使溶液凹石刚好与刻度线相切。
⑥ 滴加入蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液石比刻度线低,再加水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com