
【题目】下列关于物质分类的说法正确的是( )
A.金刚石、白磷、水银都属于单质
B.重过磷酸钙、盐酸、水煤气都属于纯净物
C.氯化铵、碳酸、碳酸钙都属于强电解质
D.木炭、硫、磷在氧气中燃烧都发出白光
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是( )
A. 该反应中氧化剂是Cl2
B. 根据该反应可判断还原性:S2O32->Cl-
C. 上述反应中,每生成lmolSO42-,可脱去2molCl2
D. SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是( )
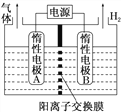
A. B极区电解液为LiCl溶液
B. 阳极电极反应式为2Cl--2e-===Cl2↑
C. 电解过程中Li+向A电极迁移
D. A极区产生0.1mol气体,则溶液中有0.4molLi+移向B电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,并将NaCl溶液换为HCl溶液,发现电流表指针仍然有偏转,下列说法正确的是( )
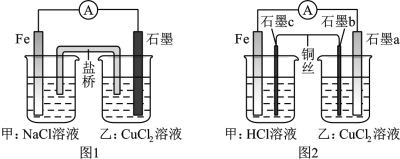
A. 图1盐桥中的阳离子移向甲装置
B. 两图都是将化学能转变成电能的装置
C. 图2中乙装置总反应的离子方程式:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
D. 图2中电子流向为Fe→电流计![]() 石墨→石墨b→石墨c→Fe
石墨→石墨b→石墨c→Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能一步实现的是( )
A.Na2SiO3→H2SiO3B.H2SiO3→SiO2
C.SiO2→H2SiO3D.SiO2→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
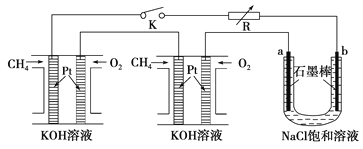
回答下列问题:
(1)甲烷燃料电池负极的电极反应式为________________________。
(2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是________,电解氯化钠溶液的总反应离子方程式为__________________________。
II.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
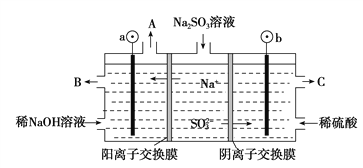
(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2)b电极SO![]() 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4· 2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5 g,放入250 mL三颈烧瓶中,加入10滴左右1.0 mol/LH2SO4溶液和15 mL蒸馏水加热溶解;
②加入25 mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O42H2O沉淀后倾析,洗涤,加入约20 mL蒸馏水搅拌并温热5 min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
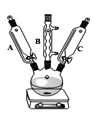
回答下列问题:
(1)仪器C的名称是____________;仪器B的作用是_____________
(2) 硫酸亚铁铵晶体用硫酸溶解的原因是____________________
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式____________________。
II、探究草酸亚铁的纯度:
①准确称取m g草酸亚铁固体样品(含有草酸铵杂质),溶于25 mL 2 mol/LH2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液;
②取上述溶液20.00 mL,用KMnO4标准溶液(浓度为c mol/L)滴定三次,平均消耗V1 mL;
③加入适量锌粉和2 mL 2 mol/L H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3 mL 2 mol/L H2SO4溶液,继续用KMnO4标准溶液(浓度为c mol/L)滴定至终点,共平行测定三次,平均消耗V2 mL。
回答下列问题:
(4)在②中溶液中发生MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式_____________用KMnO4标准溶液滴定至终点的现象是______________。
(5)计算m g固体样品的纯度为_____________(用含c、V1、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的氧化物广泛应用于磁性材料及超导材料等领域。一种利用含钴废料(主要成分Co2O3,含少量Al2O3、MgO、SiO2等)制备Co2O3的工艺流程如下图所示。
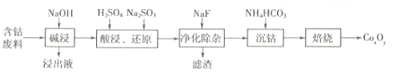
(1)“浸出液”的主要成分是________(写化学式)。
(2)“酸浸,还原”过程中溶解Co2O3的离子方程式为______________。稀硫酸和Na2SO3也可用盐酸替代,工业生产中不用盐酸的理由是_____________。
(3)NaF的作用是____________。
(4)“沉钴”时生成CoCO3的化学方程式为___________。检验CoCO3是否洗涤干净的操作方法是_______________。
(5)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com