
A.NO、NO2与NaOH反应生成了盐和水,所以它们是酸性氧化物
B.NO2是酸酐,而NO不是酸酐
C.NO能跟血红蛋白作用而引起中毒
D.NO2的氧化性比NO强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:022
氮的氧化物(NO,NO2)是主要的大气污染物之一.硝酸工厂治理尾气用下列原理:
2NO2+2NaOH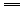 NaNO2+NaNO3+H2O
NaNO2+NaNO3+H2O
NO+NO2+2NaOH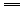 2NaNO2+H2O
2NaNO2+H2O
在标准状况下,a L NO2(其中体积分数为20%的是N2O4)和b L NO的混合气体恰好可被200 mL NaOH完全吸收.
(1)欲保证尾气完全吸收,则a∶b的值应控制在________.
(2)此NaOH溶液的物质的量的浓度是________.
(3)在标况下有2.016 L氮的氧化物恰好与50 mL 2.0 mol/L的NaOH溶液完全反应,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则混合气体中N2O4和NO2气体的体积比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:022
硝酸工业尾气中氮的氧化物(NO、NO2)是主要的大气污染物之一。可用以下方法进行治理,其主要原理可表示如下:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O。
在标准状况下,aL NO2(其中占体积分数为20%的气体是N2O4)和bL NO的混合气体恰好可被200mL NaOH溶液完全吸收。
(1)欲保证工业尾气全部被吸收,则a∶b的值应控制在_________范围。
(2)NaOH溶液的物质的量浓度是_________mol/L。
(3)试讨论a、b的值与生成的NaNO3和NaNO2物质的量(设分别为n1、n2)的比值之间的关系:
当生成的产物全部为NaNO2时,nl=_________,n2=_________;
当产物中兼有NaNO3和NaNO2时,n1=_________,n2=_________。
(4)在标准状况下,若有2.016L氮氧化物的混合物恰好与50mL2.0mol/L的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中N2O4和NO2气体的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸工业中尾气的N的氧化物(NO,NO2)是主要的大气污染之一,其常用的治理方法中有以下两种(已简化)。
NaOH吸收法,反应原理如下:
2NO2+2NaOH=NaNO3+NaNO2+H2O
氨催化还原法,反应原理是:
![]()
现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体),若用过量的NaOH吸收后,溶液中NaNO3和NaNO2的物质的量之比恰好与原尾气中NO和NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
x=__________________________________________。
(2)将1体积的该尾气用②的方法处理,至少消耗相同状况下的NH3的体积为____________。
(3)配平下列方程式:
______NOx+_____NH3=______N2+_____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸工业尾气中的氮的氧化物(NO、NO2)是主要的大气污染物,其常用的治理方法有以下两种(已简化)
①NaOH吸收法反应原理如下:2 NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+ H2O
②氨催化还原法 反应原理是:NO2+NH3→N2+H2O
现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体);若用过量的NaOH溶液吸收后溶液中 NaNO3与 NaNO2的物质的量之比恰好与尾气中NO和 NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
(2)将1体积的该尾气用氨催化还原法处理,至少消耗相同状况下多少体积的氨气?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com