
【题目】(1)在3种有机物 ① ![]() 、② CH2=CH2、③葡萄糖中,从石油中提取的重要有机溶剂是______(填序号,下同),可用作生产塑料袋的是_______。为人体提供能量的物质是_______。
、② CH2=CH2、③葡萄糖中,从石油中提取的重要有机溶剂是______(填序号,下同),可用作生产塑料袋的是_______。为人体提供能量的物质是_______。
(2)在3种无机物 ① Na2SiO3、②HNO3、③ SO2中,可用作阻燃的是______(填序号,下同),可用于漂白织物的是______, 可用作生产炸药的是______。
【答案】 ① ② ③ ① ③ ②
【解析】(1)在3种有机物 ① ![]() 、② CH2=CH2、③葡萄糖中,苯,常温下是液体,非极性分子,故从石油中提取的重要有机溶剂是①;乙烯是重要的化工原料,聚合可生成聚乙烯,故可用作生产塑料袋的是②。葡萄糖在人体中氧化后,放出大量热量,故为人体提供能量的物质是③。
、② CH2=CH2、③葡萄糖中,苯,常温下是液体,非极性分子,故从石油中提取的重要有机溶剂是①;乙烯是重要的化工原料,聚合可生成聚乙烯,故可用作生产塑料袋的是②。葡萄糖在人体中氧化后,放出大量热量,故为人体提供能量的物质是③。
(2)在3种无机物 ① Na2SiO3、②HNO3、③ SO2中, Na2SiO3溶液水解后生成硅酸胶体,附着在可燃物表面,所以可用作阻燃的是①;二氧化硫具有漂白性,可处理后用于漂白织物,所以可用于漂白织物的是③;硝酸被用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝酸酯类或含硝基的炸药。所以可用作生产炸药的是②。


科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 分离Br2和CCl4的混合物,可选用的仪器是分液漏斗和烧杯,可选用的试剂是水
B. 用盐酸除去BaSO4固体中的少量BaCO3,所需的玻璃仪器只有烧杯、玻璃棒和胶头滴管
C. 已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,则TBP不与水反应或互溶
D. 蒸馏时的接收装置如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.硫单质与金属铁反应生成FeS,体现了硫单质的氧化性
B.SO2能使酸性KMnO4、氯水褪色,说明SO2具有漂白作用
C.SO2既有还原性,又有氧化性
D.医疗上常用BaSO4作X射线透视的“钡餐”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
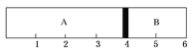
(1)A室混合气体所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氢气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作呼吸面罩中的供氧剂,应用于潜艇中。其反应原理是2Na2O2+2CO2=2Na2CO3+O2,该反应中,还原剂是________,氧化剂是________,人体每呼出22.4L CO2气体(标准状况),能够生成_________L氧气(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH2C(CH3)2CH(C2H5)CH3的准确命名是
A. 3,4 —二甲基— 4 —己基戊烷 B. 3,3,4 —三甲基己烷
C. 3,4,4 —三甲基己烷 D. 2,3,3 —三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR技术可有效降低柴油发动机尾气中NOx的排放。SCR(选择性催化还原)工作原理如图所示。
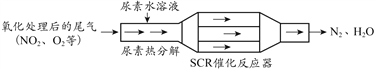
(1)汽车尾气直接排放会造成_______
a. 硝酸型酸雨 b. 硫酸型酸雨 c. 臭氧层空洞
(2)尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应器中NH3可以还原NO2,起到转化有害物质为无害物质的作用,已知参加反应的氨气与NO2的体积比为4:3,其反应方程式为_________。
(3)根据元素守恒,最终处理产物除了N2和H2O,还有_______。
(4)若通入尾气中含67.2L NO2(标准状况),则与氨气完全反应转移电子数为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH。回答下列问题:
(1)CH3SH(甲硫醇)的电子式为________。
(2)一种脱硫工艺为:真空K2CO3—克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK2=-10.3;H2SlgK1=-7,lgK2=-19)。
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) △H1=-1172kJ/mol
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2=-632kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为__________。
(3)Dalleska等人研究发现在强酸溶液中可用H2O2氧化COS。该脱除反应的化学方程式为______________。
(4)COS水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H=-35.5kJ/mol。
CO2(g)+H2S(g) △H=-35.5kJ/mol。
用活性α-Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS,COS的平衡转化率如图2所示。
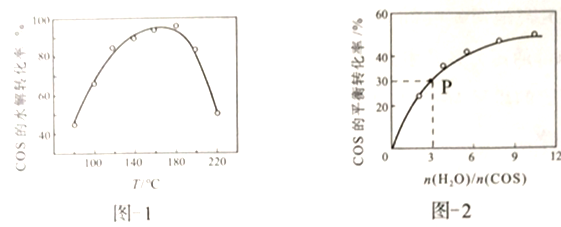
①图1活性α-Al2O3催化水解,随温度升高转化率先增大后又减小的可能原因是________。
②由图2可知,P点时平衡常数为K=______(填数字)。
③活性α-Al2O3催化水解,为提高COS的转化率可采取的措施是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载:“曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1)铁原子的外围电子排布图为___________。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________。(两个)
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示;已知铁原子半径rpm,铁晶胞空间利用率为:____________。(用字母π表示)
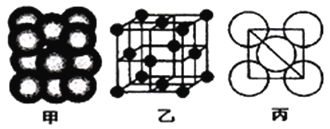
(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O中非金属元素H、N、O的电负性由大到小的顺序为:___________。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________;SO42-中S为___________杂化。
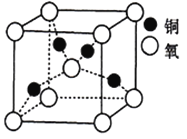
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______g/cm3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com