
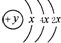 ,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.
,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.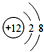 .
.分析 第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,A为硅(Si);BC可形成离子化合物B3C2,B为金属;C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P,据此解答.
解答 解:第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,A为硅(Si);BC可形成离子化合物B3C2,B为金属,C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P.
(1)A为Si元素,位于周期表中第三周期第ⅣA族,B为Mg,镁离子的结构简图为: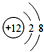 ,故答案为:第三周期第ⅣA族
,故答案为:第三周期第ⅣA族 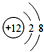 ;
;
(2)A为Si元素,C为N,N的非金属强于A,故A和C的气态氢化物的稳定性由强到弱的顺序为NH3>SiH4,NH3分子间存在氢键,故答案为:NH3>SiH4 NH3分子间存在氢键.
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>S>N,C为N,N2结构式是 N≡N,C的阴离子为N3-,与C的阴离子具有相同电子数、且有5个原子核的离子是 NH4+,故答案为:Mg>S>N N≡N NH4+.
(4)这几种元素中,元素的非金属最强的是Cl,最高价氧化物对应水化物酸性最强的含氧酸是HClO4,该元素的最高价氧化物是Cl2O7,故答案为:HClO4 Cl2O7
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、离子化合物等推断元素为解答的关键,侧重分析与应用能力的考查,注意A为Si是元素推断的突破口,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| C. | 标准状况下,33.6 LHF中含有氟原子的数目为1.5NA | |
| D. | 常温常压下,7.0 gC2H4与C3H6的混合物中含有氢原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
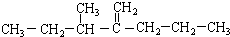 此烃名称为3-甲基-2-丙基-1-戊烯.
此烃名称为3-甲基-2-丙基-1-戊烯.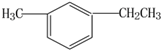 的烃可命名为-甲基-3-乙基苯.
的烃可命名为-甲基-3-乙基苯.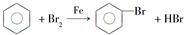 ,此反应属于取代反应.
,此反应属于取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 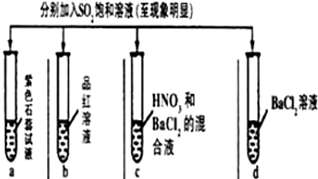 | ||||
| 记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0mol/L | B. | 1.5 mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会前期,处理废水时加入明矾可作为混凝剂可以为饮用水消毒 | |
| B. | 世博会期间,用二氧化硅制造的太阳能电池,节能减排 | |
| C. | 世博会中国馆--“东方之冠”使用的钢筋混凝土属于有机高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | 40mLlmol/LCH3COONa溶液与20mLlmol/LHCl溶液混合后溶液呈酸性,所得溶液中:c (CH3COO-)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍 己知:Ksp[Cd(0H)2]=7.2×10-15,Ksp[Co(0H)2]=1.8×10-15 | |
| D. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com