
以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。工业上铜冶炼大致可分为:
①富集:将硫化物矿石进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2→Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃主要的反应为:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2↑;
④电解精炼,在阴极得到精铜。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.电解精炼时,粗铜应与外电源的正极相连
C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂
D.每生产6mol Cu,理论上需消耗11mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,密闭容器中M、N、R三种气体的初始浓度和平衡浓度如下表所示:
| 物质 | M | N | R |
| 初始浓度/mol•L—1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol•L—1 | 0.02 | 0.21 | 0.18 |
(1)请通过计算写出此反应的化学方程式。
(2)达平衡时,N的转化率是多少?
(3)该温度下的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。工业上铜冶炼大致可分为:
①富集:将硫化物矿石进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2→Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃主要的反应为:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2↑;
④电解精炼,在阴极得到精铜。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.电解精炼时,粗铜应与外电源的正极相连
C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂
D.每生产6mol Cu,理论上需消耗11mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2+ + 2NH3·H2O → Fe(OH)2↓+ 2NH4+ 和 _________ 。(化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸、乙二酸等物质。

写出化合物A的结构简式_____________________。
上述转化过程中,属于取代反应的有____个;反应步骤B→C的目的是______________。
化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体(不含C-O-O-结构)共有_____种。
鉴别A、B、C三种物质,所需的试剂是________(选填编号)。
a.饱和FeCl3溶液,新制Cu(OH)2悬浊液 b.饱和FeCl3溶液,酸性KMnO4溶液
c.饱和FeCl3溶液,NaOH溶液 d.饱和FeCl3溶液,饱和NaHCO3溶液
设计合理方案,由 合成
合成 ,写出相关化学反应流程(无机试剂任取)。
,写出相关化学反应流程(无机试剂任取)。
(用合成路线流程图表示为:A B……
B…… 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)  4NO(g)+6H2O(g),ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g),ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的 极, 丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比依次为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)乙中发生总反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL 0.1 mol ·L-1氨水与10 mL 0.1 mol ·L-1盐酸混合,
c(Cl-)>c(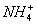 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 10 mL 0.1 mol ·L-1NH4Cl溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol ·L-1CH3COOH溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol ·L-1CH3COONa溶液与6 mL 1 mol ·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com