
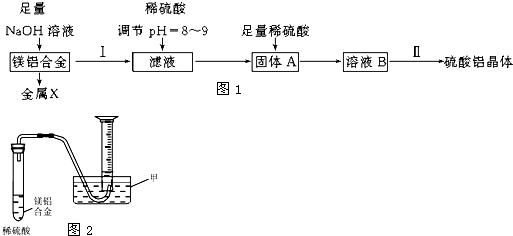
分析 (1)向镁铝合金中加入足量氢氧化钠溶液,Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应,采用过滤的方法进行分离,向滤液中加入稀硫酸条件溶液的pH,得到氢氧化铝固体,向固体中加入稀硫酸,氢氧化铝和稀硫酸反应生成硫酸铝,再将溶液加热浓缩、冷却结晶(降温结晶)、洗涤、干燥得到硫酸铝晶体;
(2)发生反应Fe3++3OH-=Fe(OH)3↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O,OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解;采用极限的方法进行解答.
解答 解:(1)向镁铝合金中加入足量氢氧化钠溶液,Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应,采用过滤的方法进行分离,向滤液中加入稀硫酸条件溶液的pH,得到氢氧化铝固体,向固体中加入稀硫酸,氢氧化铝和稀硫酸反应生成硫酸铝,再将溶液加热浓缩、结晶得到硫酸铝晶体;
①铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②操作Ⅱ包含的步骤有蒸发浓缩、冷却结晶(降温结晶)、洗涤、干燥,
故答案为:冷却结晶(降温结晶);洗涤;
③某兴趣小组为测定镁铝合金中各组成的质量分数,根据图象知,能够测得氢气体积,根据金属和氢气之间的关系式分析知,设计图1示装置需要测定的数据有氢气的体积、镁铝合金的质量,
故答案为:氢气的体积、镁铝合金的质量;
(2)Al3+、Fe3+的物质的量之和为0.10mol,n(NaOH)=2mol/L×0.16L=0.32mol,设Al3+物质的量与总物质的量的比值为x.则x=0.4时,n(Al3+)=0.04mol,n(Fe3+)=0.06mol,铁离子完全沉淀需要n(NaOH)=3n(Fe3+)=0.18mol,铝离子完全沉淀需要n(NaOH)=3n(Al3+)=0.12mol,实际上n(NaOH)大于铁离子和铝离子完全沉淀需要的氢氧化钠的物质的量,所以氢氧化钠要溶解,假设氢氧化铝完全溶解,则需要n(NaOH)=n(Al3+)=0.04mol,共需n(NaOH)=0.34mol,所以氢氧化铝未完全溶解,用于溶解氢氧化铝的氢氧化钠的物质的量为0.02mol,所以生成氢氧化铝沉淀的物质的量为0.04mol-0.02mol=0.02mol,而氢氧化铁的物质的量为0.06mol,所以沉淀的总质量为0.02×78g+0.06×107g=7.98g,
故答案为:7.98.
点评 本题以铝为载体考查了混合物的计算,根据铝离子和氢氧化钠溶液反应特点采用极限的方法进行分析,再结合原子守恒进行解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 为除去蛋白质溶液中少量的NaCl,可以利用渗析的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往NaHSO4溶液中滴加Ba(OH)2至溶液中性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| B. | SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO2═2Mn2++5SO42-+2H2O | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3?+2HClO | |
| D. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨与金刚石互为同系物 | B. | 32S与33S是同种核素 | ||
| C. | ${\;}_{2}^{4}$He原子核内含有4个质子 | D. | 二甲醚与乙醇 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g | B. | 56g | C. | 14g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:
现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)--蒸馏 | |
| B. | 从含有少量NaCl的KNO3溶液中提取KNO3--热水溶解、降温结晶、过滤 | |
| C. | 从水中分离出碘的CCl4溶液--用分液漏斗分液 | |
| D. | 将溴水中的溴转移到有机溶剂中--加入酒精萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com