
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性:HF>HCl>HBr>HI | B.酸性:HClO4>H2SO4 >H3PO4 |
| C.离子半径:N3->O2->F->Na+>Mg2+ | D.沸点:F2> Cl2> Br2> I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.47 | B.175 | C.61 | D.57 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
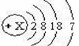
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | ||||
| | | X | Y | | |
| Z | | | M | R | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
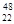 Ti和
Ti和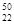 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于 (填s、p、d、ds或f)区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于 (填s、p、d、ds或f)区元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com