
【化学—选修3:物质结构与性质】(15分)CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
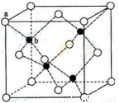
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
(1)1s22s22p63s23p63d9(或[Ar]3d9) (1分);
(2)正四面体(1分);sp3(1分);CCl4或SiCl4 (2分,其他合理答案也得分);
(3)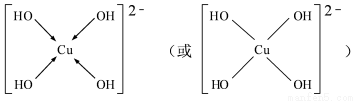 (2分);
(2分);
(4)在相同温度下,Ksp(CuS)<Ksp(ZnS),或相同温度下,CuS 比ZnS更难溶。(2分,其他合理答案也得分);
(5)低(1分),CuO晶格能比CuS大(1分,其他合理答案也得分);
(6)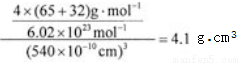 (2分,其他合理答案均得分);
(2分,其他合理答案均得分);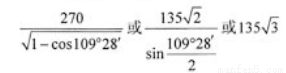 (2分,其他合理答案均得分)。
(2分,其他合理答案均得分)。
【解析】
试题分析:(1)Cu元素为29号元素,原子核外有29个电子,Cu2+核外有27个电子,Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9(或[Ar]3d9)。
(2)SO42-的价电子对数=(6+2)÷2=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42-互为等电子体的微粒有SiCl4或CCl4等
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为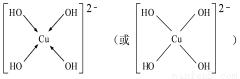
(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS。
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2-比S2-半径小,所以CuO的熔点比CuS高。
(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=1/8×8+1/2×6=4,ρ=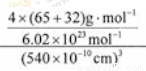 =4.1g/(cm)3;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
=4.1g/(cm)3;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270 pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270
pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270 )2,解得x=
)2,解得x=
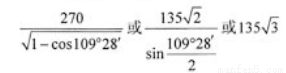 pm。
pm。
考点:本题考查核外电子排布式、杂化类型及空间构型、等电子体、配位键、熔点比较、晶胞的计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
把500ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀:另取一份加入含b mol硝酸银的溶液,恰好使卤离子完全沉淀,则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol·L-1 B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1 D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
A.3.0 mol B.1.5 mol
C.1.0 mol D.0.75 mol
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:简答题
【化学——选修2:化学与技术】(15分)
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
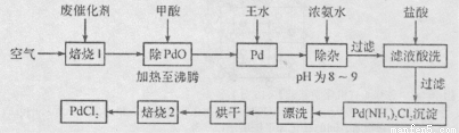
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:___ 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是: 。
(5)“焙烧2”的目的是: 。
(6)与焙烧2产生的气体组成元素相同的化合物是 ,该物质与空气形成一种环保型碱性燃料电池,其负极反应式为______________________________。
(7) Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
A.气态氢化物的稳定性:X<Z <W
B.Y的阳离子半径比W的阴离子半径小
C.X、Z、W氧化物对应水化物酸性的强弱顺序为X<Z< W
D.室温下,含Y元素的盐形成的水溶液其pH<7
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
常温下,将amol·L-1 的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
A.若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
满足分子式为C3H4ClBr不含有环的有机物共有
A.6种 B.7种 C.8种 D. 9种
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
毒豇豆、毒黄瓜等毒蔬菜中含有禁用农药水胺硫磷,水胺硫磷的结构简式如图所示,对该化合物的叙述正确的是( )
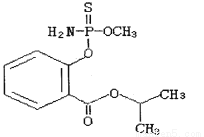
A.该化合物属于芳香烃
B.该化合物中至少有7个碳原子在同一平面
C.该化合物的分子式为C11H14O4NPS
D.该化合物能发生加聚反应、水解反应和酯化反应
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑ ②H++CO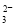 ===HCO
===HCO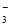 ③CO2+H2O+ClO-===HClO+HCO
③CO2+H2O+ClO-===HClO+HCO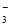 ④CO
④CO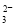 +HSO
+HSO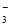 ===HCO
===HCO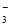 +SO
+SO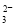 ,由此得出的如下结论中不正确的是
,由此得出的如下结论中不正确的是
A.CO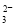 与H+、Ca2+不能大量共存 B.H2CO3的酸性比HClO强,比H2SO3弱
与H+、Ca2+不能大量共存 B.H2CO3的酸性比HClO强,比H2SO3弱
C.H2SO3是一种强酸 D.H2CO3、HClO都属于弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com