
下列说法中正确的是
A.原电池是把电能转化为化学能的装置
B.原电池中电子流入的一极是正极,发生还原反应
C.铜锌原电池中电子由锌电极经过溶液到铜电极
D.原电池中的阳离子向负极移动
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2015-2016学年吉林省高二9月检测化学试卷(解析版) 题型:选择题
人类肝脏蛋白质两谱三图三库将于2010年全面破译完成,它将为肝脏疾病的预警、预防、诊断和治疗提供科学依据。下列关于乙肝病毒的说法不正确的是
A.属于高分子化合物
B.水解的最终产物能与酸或碱反应
C.遇浓硝酸会变性
D.水解时碳氧键断裂
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次月考化学试卷(解析版) 题型:填空题
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素。(共计12分)
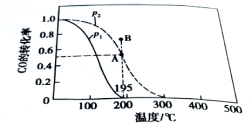
Ⅰ.若在20L的密闭容器中按物质的量之比1︰2充入CO和H2,发生反应:
CO(g)+ 2H2(g) CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
(1)p2、195℃时,0~1min内,υ(H2)= mol/(L·min)。
(2)你认为p1 p2 ; p2、195℃时,B点,υ(正) υ(逆)。(填“﹤”“﹥”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为 ;
Ⅱ.NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
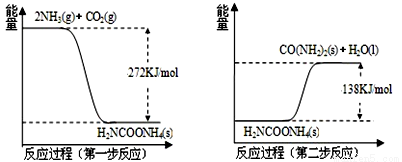
(1)NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 (填序号)
A.升高温度 B.加入催化剂
C.将尿素及时分离出去 D.增大反应体系的压强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上化学试卷(解析版) 题型:选择题
已知1—18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是
A.四种元素位于同一周期 B.氢化物的稳定性H2Y>HZ
C.离子的氧化性aW3+> bX+ D.a+3<c-2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷(解析版) 题型:选择题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)=2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法正确的是
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③2 s 时物质 B 的浓度为 0.7 mol·L-1
④2 s 时物质 A 的转化率为70%
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北大附中河南分校高二上9月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可放出热量,则该反应的△H<0
B.常温下浓硫酸与铝不反应,可用铝槽车运输
C.二氧化碳的电子式: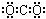
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一上10月月考化学试卷(解析版) 题型:选择题
实验室可用加热2KClO3分解的方法制取氧气,反应中使用MnO2作为催化剂,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高二上抽考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电池充电时其正极应与外电源的负极相连而成为阴极
B.氢氧燃料电池(碱性介质)的正极反应式:O2 +4e-→2O2-
C.粗铜精炼时,与电源正极相连的是纯铜
D.铁件上镀铜时,将铁件与电源的负极相连
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
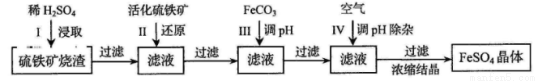
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s) 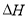 =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) 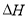 =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 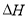 =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com