���𰸡�
������AԪ�ص�ԭ�Ӱ뾶������ԭ������С�ģ���AΪ��Ԫ�أ�
BԪ��ԭ�ӵ��������������ڲ��������2������B��2�����Ӳ㣬����BΪ̼Ԫ�أ�
CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪ��Ԫ��YΪ����泥�
A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬��EΪ��Ԫ�أ�
A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij��������DԪ��ԭ���������ڵ�Ԫ������Ԫ��֮�䣬��DΪ��Ԫ�أ�
����⣺AԪ�ص�ԭ�Ӱ뾶������ԭ������С�ģ���AΪ��Ԫ�أ�BԪ��ԭ�ӵ��������������ڲ��������2������B��2�����Ӳ㣬����BΪ̼Ԫ�أ�CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪ��Ԫ�أ�YΪ����泥�XΪ���A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬��EΪ��Ԫ�أ�A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij��������DԪ��ԭ���������ڵ�Ԫ������Ԫ��֮�䣬��DΪ��Ԫ�أ�
����AΪ��Ԫ�أ�BΪ̼Ԫ�أ�CΪ��Ԫ�أ�DΪ��Ԫ�أ�EΪ��Ԫ�أ�XΪ���ᣬYΪ����泥�
��1��EΪ��Ԫ�أ�����ˮ��Ӧ����������������������Ӧ���ӷ���ʽΪ2Na+2 H
2O=2Na
++2OH
-+H
2��������Ԫ�ػ��ϼ۽��͵ķ�Ӧ��Ϊ����������Ӧ����Ԫ�ػ��ϼ���+1�۽���Ϊ0�ۣ�H
2O ��������
�ʴ�Ϊ��2Na+2 H
2O=2Na
++2OH
-+H
2����H
2O��
��2��XΪ���ᣬYΪ����泥������£�X��Y��ˮ��Һ��pH��Ϊ5�����������������ӵ�Ũ�ȵ���ˮ�����������Ũ��Ϊ
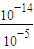
=10
-9mol/L���������Һ��������Ũ��Ϊˮ�����������Ũ��Ϊ10
-5mol/L��������ˮ��Һ����ˮ�������H
+Ũ��֮����10
-9mol/L��10
-5mol/L=10
-4��1��
�ʴ�Ϊ��10
-4��1��
��3����ѧ��Ӧ3A
2��g��+C
2��g��?2CA
3��g������H=-92.4kJ?mol
-1���÷�ӦΪ�����С�ķ��ȷ�Ӧ��
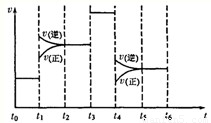
��t
��t
1�����淴Ӧ������ȣ�ƽ�ⲻ�ƶ���t
1��t
2�����淴Ӧ���ʶ��������淴Ӧ���ʴ�������Ӧ���ʣ�ƽ�����淴Ӧ�����ƶ������°����ĺ������ͣ�t
2��t
3�����淴Ӧ������ȣ�����ƽ��״̬�������ĺ������䣻t
3��t
4�����淴Ӧ���ʶ�ͬ�ȳ̶ȵ�����ƽ�ⲻ�ƶ��������ĺ������䣻t
4��t
5�����淴Ӧ���ʶ����ͣ����淴Ӧ���ʴ�������Ӧ���ʣ�����ƽ�����淴Ӧ�����ƶ��������ĺ������ͣ�t
5��t
6�����淴Ӧ������ȣ�ƽ�ⲻ�ƶ��������ĺ������䣬����ƽ��������CA
3�ĺ�����ߵ�һ��ʱ����t
��t
1��
�ʴ�Ϊ��t
��t
1��
���¶�ΪT��ʱ����5mol A
2��2mol C
2����0.5L�ܱ������У�ƽ�����C
2��ת����Ϊ50%��ת����C
2�����ʵ���Ϊ
1mol��
3A
2��g��+C
2��g��?2CA
3��g����
��ʼ 5mol 2mol 0
��Ӧ 3mol 1mol 2mol
ƽ�� 2mol 1mol 2mol
��ѧƽ�ⳣ��K=
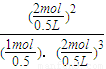
=

��L/mol��
2��
�ʴ�Ϊ��0.125��
��4��0.4mol Һ̬C
2 A
4��Һ̬˫��ˮ��Ӧ������C
2��Һ̬ˮ���ų�327.2kJ������������
Һ̬C
2 A
4��Һ̬˫��ˮ��Ӧ������C
2��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��
N
2H
4��l��+2H
2O
2��l��=N
2��g��+4H
2O��l����H=-818KJ/mol ��
H
2O��l��=H
2O��g����H=+44.0kJ/mol ��
������ʽ��×4+�ٵã�N
2H
4��l��+2H
2O
2��l��=N
2��g��+4H
2O��g����H=-642kJ?mol
-1��
�ʴ�Ϊ��N
2H
4��l��+2H
2O
2��l��=N
2��g��+4H
2O��g����H=-642kJ?mol
-1��
���������⿼����Ԫ�ص��жϡ����ӷ���ʽ���Ȼ�ѧ����ʽ����д����ѧƽ���ƶ�������жϵ�֪ʶ�㣬�ѵ��Ǹ���ͼ���з�Ӧ���ʵı仯�ж�ƽ�� �ƶ��ķ���

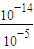 =10-9mol/L���������Һ��������Ũ��Ϊˮ�����������Ũ��Ϊ10-5mol/L��������ˮ��Һ����ˮ�������H+Ũ��֮����10-9mol/L��10-5mol/L=10-4��1��
=10-9mol/L���������Һ��������Ũ��Ϊˮ�����������Ũ��Ϊ10-5mol/L��������ˮ��Һ����ˮ�������H+Ũ��֮����10-9mol/L��10-5mol/L=10-4��1��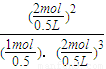 =
= ��L/mol��2��
��L/mol��2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�










 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������