
【化学—选修2 化学与技术】
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:

已知:① FePO4可溶于稀H2SO4,不溶于水和其他的酸。
② Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
在373K下,Li2CO3的溶解度为0.72g
③ Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)操作1为: 。
(2)滤液A中通入过量CO2的化学方程式为: 。
(3)可以提高操作1浸出率的方法有(写出3种) 。
(4)完成操作3中的离子方程式: 。
(5)该锂电池充电时的阳极反应式: 。
(6)操作4中应选择试剂: 。
(7)沉淀C的成分: 。
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4] <c[NH4HSO4]<c(NH4Cl)
B.欲除去CuC12溶液中混有少量的FeC13,可加入CuO
C.0.2 mol/LHCl溶液与等体积0.05mol/LBa(OH)2溶液混合后,溶液的pH=1
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:填空题
为了测定某氯酸钾与二氧化锰混合物中氯酸钾的质量分数,课外小组的同学设计了如下实验:取3.0g 混合样品放入如图所示的大试管中,充分加热,直到反应完全,并用如图所示装置测量出生成氧气的体积。试回答下列问题:
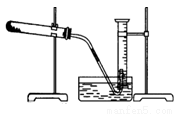
(1)如何检查装置的气密性?
(1)现有如下可供选择的操作:①将导气管放入盛满水的量筒内;②给药品加热;③有连续气泡产生时开始收集气体;④取出导气管;⑤反应完全后停止加热(如图,此时导管出口略高于液面);⑥冷却至室温;⑦调整量筒内外液面高度使之相同后读出量筒内气体体积数。
为了较准确地测量出生成的氧气在常温、常压下的体积,正确的操作顺序是(填序号)______________。
(3)为了较准确地测量到气体的体积,需要调整量筒内外液面高度,其原理是:____________________。
(4)在常温常压下共收集到气体680mL(此时氧气密度为1.41g·L-1),其质量为_______g,原混合物中氯酸钾的质量分数约是______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:选择题
学习化学的目的是运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题。下列说法中,你认为不正确的是( )
A.搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度
B.天气闷热时,鱼塘的鱼会接近水面游动,原因是温度高压强小,氧气的溶解度小
C.夏天,铜制眼镜架表面出现的绿色物质[主要成分Cu2(OH)2CO3],可用稀盐酸除去
D.敞口放置的酒精没有燃烧的原因是温度没有达到酒精的着火点
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:选择题
你认为下列实验方案中,可行的是( )
A. 按溶解、过滤、蒸发的操作顺序可以分离CaCl2、CaCO3的混合物
B. 向某种未知溶液中加入AgNO3溶液,产生白色沉淀,证明溶液是盐酸
C. 用镁在密闭容器中燃烧,除去密闭容器内空气中的氧气
D. 将pH试纸润湿后,用玻璃棒蘸取食用白醋滴在试纸上,测定其pH
查看答案和解析>>
科目:高中化学 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
下列有关说法中正确的是
A. 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上9月月考化学试卷(解析版) 题型:推断题
端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H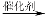 R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
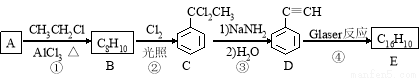
回答下列问题:
(1)B的结构简式为 ,D 的化学名称为 。
(2)①和③的反应类型分别为 、 。
(3)E的结构简式为 。用1 mol E合成1,4-二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(HC≡C C≡CH)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_______________________。
C≡CH)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_______________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中一种的结构简式_____________________。
(6)写出用2-苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市央民族大学附高三上9.12周练化学卷(解析版) 题型:选择题
下列说法正确的是
A.NA表示阿伏加德罗常数,1 mol Na被完全氧化生成Na2O2,失去2NA个电子
B.Na2O2用作呼吸面具的供氧剂涉及氧化还原反应
C.苏打是面包发酵粉的主要成分之一
D.NaHCO3的热稳定性大于Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上起点考试化学卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的有( )个
①.标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0.1NA
②.常温常压下,等物质的量的 N2与CO气体含有的原子数目均为NA
③.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
④.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
⑤.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
⑥.1 mol Fel2与足量氯气反应时转移的电子数为2NA
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com