
将
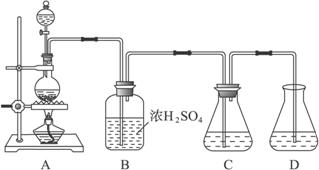
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
解析:浓H2SO4为氧化性酸,与Cu反应生成SO2,SO2的水溶液为H2SO3,H2SO3的酸性比H2CO3强,SO2与Na2CO3溶液作用可产生Na2SO3和CO2,其反应方程式分别为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,SO2+Na2CO3=Na2SO3+CO2↑。
CuSO4+SO2↑+2H2O,SO2+Na2CO3=Na2SO3+CO2↑。
答案:(1)取10 mL蒸馏水放在烧杯中,沿烧杯壁将60 mL浓H2SO4缓缓注入水中,同时不断搅拌。
(2)干燥,且可根据放出气体的快慢程度判断SO2的生成速度
(3)充分吸收SO2 2SO2+![]() +H2O=CO2↑+
+H2O=CO2↑+![]()
(4)观察B中出现气体的快慢,通过加热控制反应速度,当B中气体放出过快,可移去酒精灯,待缓和后再用小火加热
(5)使NaHSO3转化为Na2SO3


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示:

将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届湖北省新高三起点调研化学试卷(解析版) 题型:实验题
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。
回答下列问题:
(1)在合成装置中,甲装置的名称是 。
(2)三颈烧瓶的容量为 (填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是____ 。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是 。然后加入精制食盐使之变成饱和溶液,将混合液倒人____ 中,分离得到有机层。
(5)用如上右图对粗产品进行精制,蒸馏收集____ ℃的馏分。
(6)检验坏己酮是否纯净,可使用的试剂为____ 。
A.重铬酸钾溶液 B.金属钠 C.新制的氢氧化铜悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com